Die konstriktive Perikarditis (CP) ist eine relativ seltene Form der klinischen Herzinsuffizienz. Die tatsächliche Prävalenz in der Bevölkerung ist nicht bekannt, aber man schätzt, dass sie bei Personen mit viraler Perikarditis in weniger als 0,5 % der Fälle auftritt.1 Da sie jedoch potenziell reversibel ist, darf die Diagnose nicht verpasst werden. Eine chirurgische Perikardektomie kann die CP „heilen“ und zu einer deutlichen Verbesserung der Symptome und der Lebensqualität führen.2,3 Obwohl die Ätiologie der CP vielfältig sein kann (idiopathisch, postviral, tuberkulös, postoperativ, strahleninduziert usw.), ist der letzte gemeinsame Weg die Entwicklung einer fibrösen Verdickung oder Verkalkung des Perikards, die zu einer perikardialen Non-Compliance führt.
Perikardiale Physiologie und Pathophysiologie bei Konstriktion:
Das normale Perikard behindert die ventrikuläre Dehnbarkeit bei normalem kardialen Arbeitsvolumen nur minimal. Bei CP führt die Nichtnachgiebigkeit des Perikards zu einer steifen ventrikulär-perikardialen Einheit, was zu einem erhöhten diastolischen Druck und einem schnelleren Anstieg des ventrikulären Drucks bei einem gegebenen venösen Rückfluss führt. Das nicht nachgiebige Perikard begrenzt die ventrikuläre Relaxation und bestimmt den ventrikulären diastolischen Druck, was zu erhöhten, gleichmäßigen diastolischen Drücken in allen Kammern führt. Klinisch zeigt sich dies vor allem als rechtsseitige Stauung (Jugularvenendistention, Ödeme und Aszites). Ein erhöhter pulmonaler Kapillar-Keildruck und ein vermindertes Herzzeitvolumen bei körperlicher Anstrengung (aufgrund einer unzureichenden Ventrikelfüllung) führen zu Dyspnoe und Anstrengungsunverträglichkeit, obwohl ein offenes Lungenödem seltener auftritt als eine typische systolische Herzinsuffizienz.
Das normale Perikard reguliert die Kopplung von linksseitigem und rechtsseitigem Schlagvolumen bei akuten Veränderungen der Vorlast, so dass ein plötzlicher Anstieg des rechtsseitigen venösen Rückflusses (während der Inspiration) mit einer Wölbung des Septums nach links und einer Abnahme des transmuralen Füllungsdrucks des linken Ventrikels (diastolischer LV-Druck im Perikard) verbunden ist. Dies wiederum verringert das enddiastolische LV-Volumen (LV-Vorlast) und damit das linksseitige Schlagvolumen.4 Beim normalen Herzen sind diese Änderungen des Schlagvolumens mit der Atmung minimal. Angesichts eines festen Perikardvolumens bei CP ist die perikardiale Kopplung stark übertrieben, was zu einer dramatischen ventrikulären Interdependenz führt. Abnormale Ventrikelseptalbewegungen resultieren aus verstärkten respirophasischen Veränderungen des links- und rechtsseitigen Schlagvolumens.
Bei CP wird der normale inspiratorische Abfall des intrathorakalen Drucks nicht auf den intrakardialen Druck übertragen, da das Herz von einem nicht nachgiebigen Perikard umschlossen ist. Dieser Effekt verstärkt den inspiratorischen Abfall des pulmonalvenösen Drucks (da die Pulmonalvenen primär extraperikardial liegen), was zu einer reduzierten linksseitigen inspiratorischen Vorlast führt und das linksseitige inspiratorische Schlagvolumen weiter verringert. Die multimodale diagnostische Auswertung der CP hebt diese Befunde hervor und erleichtert die Diagnose.
Erstuntersuchung:
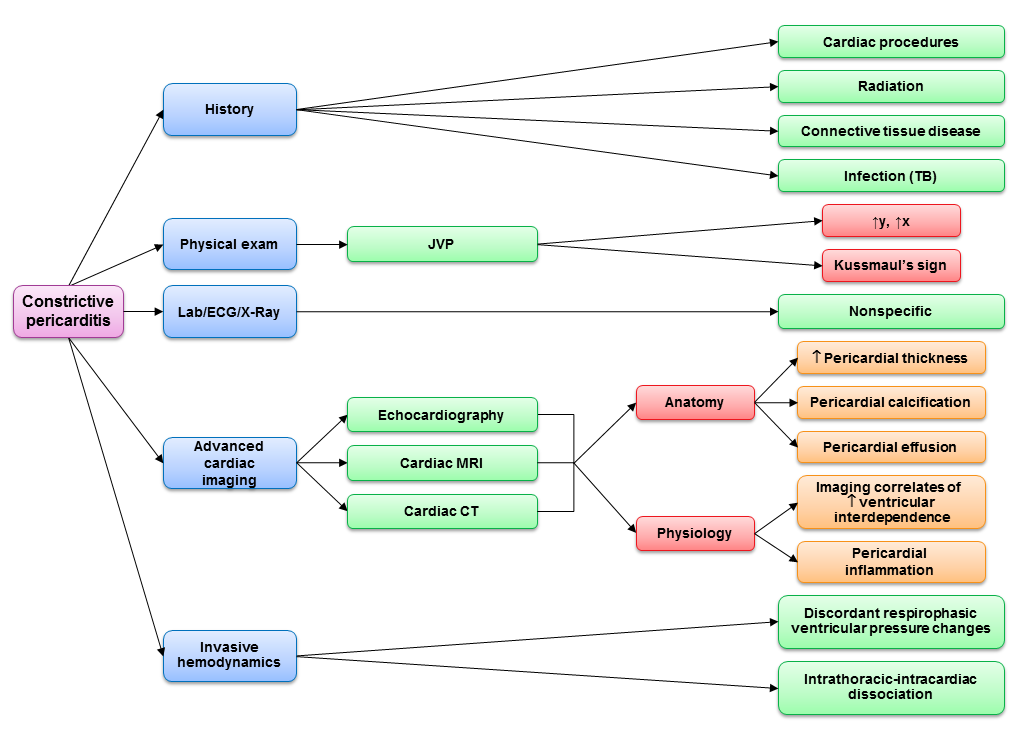
Die geringe Prävalenz der CP macht die Identifizierung der wichtigsten körperlichen Untersuchungs- und Anamnesemerkmale zu einem wichtigen ersten Schritt im diagnostischen Prozess. Eine Anamnese von Herzoperationen, Bestrahlung oder Tuberkulose sollte den klinischen Verdacht erhöhen, wenn Ödeme, abdominale Distension und Belastungsdyspnoe vorhanden sind. Ein erhöhter Jugularvenendruck (JVP) ist bei praktisch allen Patienten vorhanden, die nicht hypovolämisch sind. Eine perikardiale Einengung führt dazu, dass das rechte Herz nicht in der Lage ist, den inspiratorischen abdominalen Venenrückfluss zu bewältigen, was zu einem inspiratorischen Anstieg des JVP führt (Kussmaul-Zeichen).5 Die juguläre x- und y-Senkung ist bei CP ausgeprägt, was auf eine übertriebene longitudinale Ringbewegung bzw. eine ausgeprägte frühe Ventrikelfüllung zurückzuführen ist. Im Gegensatz dazu ist bei restriktiver Kardiomyopathie die x-Senkung aufgrund einer gestörten atrialen Relaxation und einer atrialen Myopathie abgeschwächt. Bei der Auskultation kann ein hochfrequentes Perikardklopfen entlang der linken Sternumgrenze festgestellt werden. Aszites und signifikante Ödeme im unteren Bereich sind häufig und führen oft zur Fehldiagnose einer Lebererkrankung, wenn die JVP-Befunde nicht erkannt werden.
Laboruntersuchungen bei CP sind unspezifisch. Ein hoher BNP-Wert kann auf eine größere Wahrscheinlichkeit einer restriktiven Kardiomyopathie hindeuten, aber Studien haben gezeigt, dass sich die Diagnosewerte in dieser Population stark überschneiden, was den klinischen Nutzen einschränkt.6-9
Echokardiographie:
Als initialer diagnostischer Test kann die Echokardiographie die Diagnose einer CP in den meisten Fällen bestätigen, wenn die Vortestwahrscheinlichkeit ausreichend hoch ist.10 Die Echokardiographie zeigt sowohl Merkmale einer übertriebenen ventrikulären Interdependenz als auch eine intrathorakal-intrakardiale Dissoziation. Der pathognomonische Befund ist eine respirophasische Septumverschiebung, die entweder durch M-Mode- oder 2D-Bildgebung nachgewiesen werden kann.5 Zusätzlich zu dieser übertriebenen respiratorischen Septalbewegung gibt es auch eine abnormale Schlag-zu-Schlag-Septalbewegung oder ein „Zittern“, das auf eine unterschiedlich schnelle frühe diastolische Füllung des rechten und dann des linken Ventrikels zurückzuführen ist.11 Die Vena cava inferior ist bei fehlender Hypovolämie durchgängig plethorisch; ein empfindliches, aber unspezifisches Merkmal der CP. Exspiratorische Lebervenenumkehrungen und ein verminderter diastolischer Vorwärtsfluss treten aufgrund einer rechtsseitigen Ventrikelseptalbewegung infolge einer exspiratorischen Erhöhung der LV-Vorlast auf, was zu einer Verringerung der effektiven rechtsventrikulären Compliance führt.
Die übertriebenen Veränderungen der respiratorischen Vorlast werden auch durch eine inspiratorische Verringerung des Mitralklappen-Doppler-Einstroms und eine Erhöhung des Trikuspidalklappen-Doppler-Einstroms veranschaulicht. Diese Befunde sind jedoch unempfindlich. Bei signifikant erhöhtem linksatrialem und pulmonalkapillärem Keildruck reicht die Abnahme des Keildruck-LV-Gradienten bei Inspiration nicht aus, um die LV-Vorlast ausreichend zu verändern, um die Größe des Mitraleinstrom-Dopplers zu verändern.12 Aufgrund der Seitenwandbindung ist die frühdiastolische Gewebedoppler-Geschwindigkeit (e‘) des lateralen Mitralanulus häufig vermindert und abnormal niedriger als die mediale e‘-Geschwindigkeit (Annulus reversus).13 Im Gegensatz zu kardiomyopathischen Ursachen der Herzinsuffizienz ist die mediale e‘-Geschwindigkeit relativ normal (oder sogar erhöht, was als Annulus paradoxus bezeichnet wird), wenn eine normale Myokardrelaxation und eine kompensatorische mediale Längsbewegung des Anulus im Rahmen der Seitenwandbindung vorliegt.14,15
Herzradiologie:
Bei CP kann im Röntgenbild des Brustkorbs eine Perikardverkalkung nachgewiesen werden, ein pathognomonischer Befund bei klinischer Herzinsuffizienz und erhöhter JVP. Die Thorax-CT ist empfindlicher für Perikardverkalkung als das Thorax-Röntgenbild.16 Thorax-CT und MRT ermöglichen eine präzise Messung der Perikarddicke, wobei insbesondere die MRT eine ausgezeichnete Genauigkeit (93 %) bei der Erkennung von Perikardverdickungen >4 mm aufweist.17 Es ist jedoch wichtig, daran zu denken, dass bis zu 18 % der Fälle von chirurgisch bestätigter CP trotz pathologischer Nichteinhaltung eine normale Perikarddicke aufweisen können.18 Perikardtethering, der mittels Echokardiographie, CT oder MRT sichtbar gemacht werden kann, kann ebenfalls Aufschluss über das Vorhandensein von CP geben. Die MRT liefert Informationen über eine aktive Herzbeutelentzündung, die bei therapeutischen Entscheidungen hilfreich sein können. Darüber hinaus bietet die kardiale MRT eine einzigartige Beurteilung des Myokards, wodurch kardiomyopathische Prozesse identifiziert werden können, wenn die Diagnose unsicher ist. Myokardiales Delayed Enhancement ist bei isolierter CP typischerweise nicht vorhanden, kann aber in fast einem Drittel der Fälle mit restriktiver Kardiomyopathie auftreten.19
Im Gegensatz zur Echokardiographie sind kardiales CT und MRT nicht vom Habitus des Patienten abhängig und können eine bessere Darstellung des Herzens ermöglichen, wenn die echokardiographische Bildgebung suboptimal ist. Respirophasische Verschiebungen der Septumbewegung lassen sich sowohl mit CT als auch mit MRT gut darstellen. Darüber hinaus können CT und MRT Informationen über alternative Ursachen der Dyspnoe wie Lungenerkrankungen oder Zwerchfelllähmung liefern.
Diagnose über die kardiale Bildgebung hinaus:
Die Herzkatheteruntersuchung ist nach wie vor der diagnostische Goldstandard, wenn nicht-invasive Tests nicht schlüssig sind, um das Vorhandensein von Verengungen zu beurteilen und die hämodynamische Bedeutung zu bewerten. Während bei den meisten Patienten mit CP keine hämodynamische Katheteruntersuchung zur Diagnose erforderlich ist, ist eine Untergruppe von besonderem Interesse: Patienten mit Strahlenherzerkrankungen, bei denen es oft schwierig ist, das Ausmaß der zugrunde liegenden restriktiven Kardiomyopathie zu erkennen, selbst wenn Verengungsmerkmale vorhanden sind. Selbst bei einer qualitativ hochwertigen Echokardiographie und Herzradiographie kann bei diesen Patienten eine invasive hämodynamische Katheterisierung erforderlich sein, um eine Erhöhung des Füllungsdrucks mit diastolischem Ausgleich, eine ventrikuläre Interdependenz und eine intrathorakal-intrakardiale Dissoziation festzustellen.2
Behandlung:
Wenn eine CP festgestellt wird, ist eine medikamentöse Behandlung mit Diurese oft nur bedingt wirksam, um die Symptome zu lindern. Wenn eine ausgedehnte Herzbeutelentzündung vorliegt, sollte vor einer Perikardektomie eine entzündungshemmende Therapie erprobt werden, um festzustellen, ob sie reversibel ist. Bei einigen Patienten kann sich die perikardiale Compliance verbessern, wenn sie nur eine vorübergehende entzündungsbedingte Verengung aufweisen.20 Eine vollständige chirurgische Perikardektomie ist indiziert, um die Symptome bei Patienten mit CP zu lindern. Bei Anwendung eines multimodalen diagnostischen Ansatzes (Abbildung 1) ist es heute ungewöhnlich, dass Patienten zur Bestätigung einer CP in den Operationssaal gebracht werden. Da die Perikardektomie die Lebensqualität der Patienten häufig verändert, müssen Kliniker weiterhin einen hohen Verdachtsindex für diese seltene, aber heilbare Form der Herzinsuffizienz aufrechterhalten.
Abbildung 1
- Imazio M, Brucato A, Maestroni S, et al. Risk of constrictive pericarditis after acute pericarditis. Circulation 2011;124:1270-5.
- Geske JB, Anavekar NS, Nishimura RA, Oh JK, Gersh BJ. Unterscheidung von Konstriktion und Restriktion: komplexe kardiovaskuläre Hämodynamik. J Am Coll Cardiol 2016;68:2329-47.
- Ling LH, Oh JK, Schaff HV, et al. Constrictive pericarditis in the modern era: evolving clinical spectrum and impact on outcome after pericardiectomy. Circulation 1999;100:1380-6.
- Kroeker CA, Shrive NG, Belenkie I, Tyberg JV. Das Perikard moduliert das links- und rechtsventrikuläre Schlagvolumen, um plötzliche Änderungen des Vorhofvolumens zu kompensieren. Am J Physiol Heart Circ Physiol 2003;284:H2247-54.
- Talreja DR, Nishimura RA, Oh JK, Holmes DR. Konstriktive Perikarditis in der modernen Ära: neue Kriterien für die Diagnose im Herzkatheterlabor. J Am Coll Cardiol 2008;51:315-9.
- Sengupta PP, Krishnamoorthy VK, Abhayaratna WP, et al. Comparison of usefulness of tissue Doppler imaging versus brain natriuretic peptide for differentiation of constrictive pericardial disease from restrictive cardiomyopathy. Am J Cardiol 2008;102:357-62.
- Leya FS, Arab D, Joyal D, et al. The efficacy of brain natriuretic peptide levels in differentiating constrictive pericarditis from restrictive cardiomyopathy. J Am Coll Cardiol 2005;45:1900-2.
- Babuin L, Alegria JR, Oh JK, Nishimura RA, Jaffe AS. Hirnnatriuretische Peptidspiegel bei konstriktiver Perikarditis und restriktiver Kardiomyopathie. J Am Coll Cardiol 2006;47:1489-91.
- Reddy PR, Dieter RS, Das P, Steen LH, Lewis BE, Leya FS. Nützlichkeit von BNP bei der Unterscheidung zwischen konstriktiver Perikarditis und restriktiver Kardiomyopathie bei Patienten mit Niereninsuffizienz. J Card Fail 2007;13:668-71.
- Welch TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc Imaging 2014;7:526-34.
- Coylewright M, Welch TD, Nishimura RA. Mechanismus der Septumsprengung bei konstriktiver Perikarditis: eine gleichzeitige Herzkatheteruntersuchung und echokardiographische Studie. Heart 2013;99:1376.
- Oh JK, Tajik AJ, Appleton CP, Hatle LK, Nishimura RA, Seward JB. Vorlastreduktion zur Demaskierung der charakteristischen Doppler-Merkmale der konstriktiven Perikarditis: eine neue Beobachtung. Circulation 1997;95:796-9.
- Reuss CS, Wilansky SM, Lester SJ, et al. Using mitral ‚annulus reversus‘ to diagnose constrictive pericarditis. Eur J Echocardiogr 2009;10:372-5.
- Ha JW, Oh JK, Ling LH, Nishimura RA, Seward JB, Tajik AJ. Annulus paradoxus: Das Verhältnis der transmitralen Flussgeschwindigkeit zur Geschwindigkeit des Mitralrings ist bei Patienten mit konstriktiver Perikarditis umgekehrt proportional zum pulmonalen Kapillarkeildruck. Circulation 2001;104:976-8.
- Ha JW, Ommen SR, Tajik AJ, et al. Differentiation of constrictive pericarditis from restrictive cardiomyopathy using mitral annular velocity by tissue Doppler echocardiography. Am J Cardiol 2004;94:316-9.
- Ling LH, Oh JK, Breen JF, et al. Calcific constrictive pericarditis: is it still with us? Ann Intern Med 2000;132:444-50.
- Masui T, Finck S, Higgins CB. Konstriktive Perikarditis und restriktive Kardiomyopathie: Bewertung mit MR-Bildgebung. Radiology 1992;182:369-73.
- Talreja DR, Edwards WD, Danielson GK, et al. Constrictive pericarditis in 26 patients with histologically normal pericardial thickness. Circulation 2003;108:1852-7.
- Muehlberg F, Toepper A, Fritschi S, Prothmann M, Schulz-Menger J. Magnetic resonance imaging applications on infiltrative cardiomyopathies. J Thorac Imaging 2016;31:336-47.
- Haley JH, Tajik AJ, Danielson GK, Schaff HV, Mulvagh SL, Oh JK. Transiente konstriktive Perikarditis: Ursachen und natürlicher Verlauf. J Am Coll Cardiol 2004;43:271-5.
Klinische Themen: Herzchirurgie, Herzinsuffizienz und Kardiomyopathien, Invasive kardiovaskuläre Angiographie und Intervention, Nichtinvasive Bildgebung, Perikarderkrankung, Herzchirurgie und Herzinsuffizienz, Akute Herzinsuffizienz, Chronische Herzinsuffizienz, Interventionen und Bildgebung, Computertomographie, Echokardiographie/Ultraschall, Kernspintomographie
Schlüsselwörter: Blutdruck, Herzkatheterisierung, Kardiomyopathie, restriktiv, Diagnosefehler, diagnostische Tests, Routine, Diurese, Dyspnoe, Echokardiographie, Ödem, Herzinsuffizienz, systolisch, Herzkammern, Lebervenen, Hypovolämie, Mitralklappe, Perikardiektomie, Perikarditis, konstriktiv, Herzbeutel, Lungenödem, Lungenvenen, Lungenkeildruck, Trikuspidalklappe, Tomographie, Röntgen, Vena Cava, inferior, Venendruck, Ventrikulärer Druck, Röntgenbilder
< Zurück zu den Einträgen