A szűkületes perikarditis (CP) a klinikai szívelégtelenség viszonylag ritka formája. A valódi populációs prevalenciája nem ismert, de a vírusos pericarditisben szenvedők körében a becslések szerint az esetek kevesebb mint 0,5%-ában fordul elő.1 Mivel azonban potenciálisan reverzibilis, a diagnózist nem szabad kihagyni. A sebészi pericardiectomia képes “meggyógyítani” a CP-t, ami a tünetek és az életminőség drámai javulásával jár.2,3,3 Bár a CP etiológiája változatos lehet (idiopátiás, vírusos, tuberkulózisos, műtét utáni, sugárzás okozta stb.), a végső közös út a perikardium rostos megvastagodásának vagy meszesedésének kialakulása, ami a perikardium nem megfelelőségét eredményezi.
A perikardium élettana és patofiziológiája a szűkületben:
A normális perikardium minimálisan akadályozza a kamrai distenciát normál szívműködési térfogat mellett. CP-ben a pericardium nem megfelelősége merev kamra-pericardium egységet hoz létre, ami megnövekedett diasztolés nyomáshoz és a kamrai nyomás gyorsabb emelkedéséhez vezet adott vénás visszatérés esetén. A nem megfelelő perikardium korlátozza a kamrai relaxációt és meghatározza a kamrai diasztolés nyomást, ami emelkedett, kiegyenlített diasztolés nyomást eredményez minden kamrában. Klinikailag ez túlnyomórészt jobb oldali pangásként jelentkezik (jugularis vénatágulat, ödéma és ascites). A pulmonális kapilláris éknyomás emelkedése és a terhelésre adott csökkent szívteljesítmény-válasz (a kamratöltés elégtelensége miatt) dyspnoét és erőkifejtési intoleranciát eredményez, bár a nyílt tüdőödéma ritkább, mint a tipikus szisztolés szívelégtelenség.
A normális perikardium szabályozza a bal- és jobboldali lüktető térfogatok összekapcsolódását a preload akut változásai során, úgy, hogy a jobboldali vénás visszatérés hirtelen növekedése (inspiráció során) baloldali szeptumhajlással és a bal kamra (LV) transzmurális töltőnyomás csökkenésével jár (LV diasztolés nyomás perikardiumnyomás). Ez viszont csökkenti az LV végdiasztolés térfogatot (LV-előterhelés) és ezáltal a bal oldali lökettérfogatot.4 A normális szívben a lökettérfogatnak ezek a légzéssel járó változásai minimálisak. Fix perikardiális térfogat mellett CP-ben a perikardiális csatolás nagymértékben eltúlzott, ami drámai kamrai interdependenciához vezet. A kamrai szeptum rendellenes mozgása a bal- és jobb oldali lüktető térfogat fokozott respirofázisos változásainak eredménye.
CP-ben, mivel a szívet nem rugalmas szívburok veszi körül, az intrathoracalis nyomás normális inspirációs csökkenése nem jut át az intracardialis nyomásba. Ez a hatás felerősíti a tüdővénás nyomás inspirációs csökkenését (mivel a tüdővénák elsősorban extraperikardiálisak), ami csökkent baloldali inspirációs előterhelést eredményez, tovább csökkentve a baloldali inspirációs lökettérfogatot. A CP multimodális diagnosztikai értékelése kiemeli ezeket a megállapításokat, megkönnyítve a diagnózis felállítását.
Első felmérés:
A CP alacsony prevalenciája miatt a legfontosabb fizikális vizsgálati és anamnézisbeli jellemzők azonosítása a diagnosztikai folyamat fontos kezdeti lépése. Szívműtét, sugárkezelés vagy tuberkulózis anamnézisének fokoznia kell a klinikai gyanút ödéma, haspuffadás és terheléses nehézlégzés jelenlétében. Az emelkedett nyaki vénás nyomás (JVP) gyakorlatilag minden olyan betegnél jelen van, aki nem hipovolémiás. A pericardialis szorítás azt eredményezi, hogy a jobb szív nem képes befogadni az inspirációs hasi vénás visszatérést, ami a JVP inspirációs emelkedéséhez vezet (Kussmaul-jel).5 CP-ben a jugularis x- és y-lejtő kiemelkedő, ami a túlzott hosszanti gyűrűs mozgásnak, illetve a kiemelkedő korai kamratöltésnek tudható be. Ezzel szemben restriktív kardiomiopátia esetén a pitvari relaxáció és a pitvari myopathia miatt tompul az x-lejtés. Az auskultáció magas hangú perikardiális kopogást fedezhet fel a bal szegycsonti határ mentén. Az ascites és a jelentős alsó ödéma gyakori, és gyakran vezet a májbetegség téves diagnózisához, ha a JVP-leleteket nem ismerik fel.
A CP-ben végzett laboratóriumi vizsgálatok nem specifikusak. A magas BNP nagyobb valószínűséggel utalhat restriktív kardiomiopátiára, de a vizsgálatok nagy átfedést mutattak a diagnosztikus értékekben ebben a populációban, ami korlátozza a klinikai hasznosságot.6-9
Echokardiográfia:
Az echokardiográfia mint kezdeti diagnosztikus vizsgálat a legtöbb esetben megerősítheti a CP diagnózisát, ha a vizsgálat előtti valószínűség kellően magas.10 Az echokardiográfia mind a túlzó kamrai egymásra utaltság, mind az intrathoracalis-intracardialis disszociáció jellemzőit mutatja. A patognomonikus lelet a respirofázisos szeptumeltolódás, amelyet M-módban vagy 2D-s képalkotással lehet kimutatni.5 E túlzó respirációs szeptummozgás mellett a jobb, majd a bal kamra differenciálisan gyors korai diasztolés töltése miatt abnormális ütemenkénti szeptummozgás vagy “remegés” is megfigyelhető.11 A vena cava inferior hypovolaemia hiányában általánosan plethorikus; ez a CP érzékeny, de nem specifikus jellemzője. Az exspiratorikus hepatikus vénás visszafordulás és a csökkent diasztolés előremenő áramlás a jobb kamrai szeptum jobbra irányuló mozgása miatt következik be az LV előfeszültség exspiratorikus növekedése miatt, aminek következtében csökken a hatékony működési jobb kamrai compliance.
A túlzott légzési előfeszültség-változást a mitrális billentyű beáramlási Doppler inspirációs csökkenése és a tricuspidalis billentyű beáramlási Doppler növekedése is példázza. Ezek a leletek azonban érzéketlenek. A jelentősen megnövekedett bal pitvari és pulmonális kapilláris éknyomás jelenlétében az éknyomás-LV gradiens csökkenése inspirációval nem elegendő ahhoz, hogy az LV-előterhelés eléggé megváltozzon ahhoz, hogy a mitrális beáramlás Doppler-magnitúdója megváltozzon.12 Az oldalsó fal tethering miatt a laterális mitralis annulus korai diasztolés szöveti Doppler-sebesség (e’) gyakran csökkent és kórosan alacsonyabb, mint a mediális e’ sebesség (annulus reversus).13 A szívelégtelenség kardiomiopátiás okaival ellentétben a mediális e’ sebesség viszonylag normális (vagy akár megnövekedett, amit annulus paradoxusnak nevezünk), mivel a szívizom normál relaxációja és a mediális gyűrű kompenzációs hosszirányú mozgása az oldalsó fal tetheringje mellett is fennáll.14,15
Szívradiológia:
CP esetén a mellkasi röntgenfelvételeken perikardiális meszesedés mutatható ki, ami klinikai szívelégtelenség és emelkedett JVP jelenlétében patognomikus lelet. A mellkas CT érzékenyebb a perikardiális meszesedés kimutatására, mint a mellkasröntgen.16 A mellkas CT és az MRI lehetővé teszi a perikardiális vastagság pontos mérését, különösen az MRI kiváló pontosságot (93%) mutat a >4 mm-es perikardiális vastagodás kimutatásában.17 Fontos azonban megjegyezni, hogy a műtétileg igazolt CP eseteinek akár 18%-ában a kóros nem megfelelőség ellenére is lehet normális perikardiális vastagság.18 A perikardiális tethering, amely echokardiográfiával, CT-vel vagy MRI-vel láthatóvá tehető, szintén betekintést nyújthat a CP jelenlétébe. Az MRI információt közvetít az aktív perikardiális gyulladásról, ami segíthet a terápiás döntések meghozatalában. Továbbá, a szív MRI egyedi szívizomvizsgálatot biztosít, amely azonosíthatja a kardiomiopátiás folyamatokat, ha a diagnózis bizonytalan. A szívizom késleltetett fokozódása izolált CP-ben általában hiányzik, de restriktív kardiomiopátiában az esetek közel egyharmadában előfordulhat.19
Az echokardiográfiával ellentétben a szív CT és MRI nem függ a beteg habitusától, és jobb szívképet biztosíthat, ha az echokardiográfiás képalkotás nem optimális. A szeptális mozgás respirofázisos elmozdulásai mind a CT-n, mind az MRI-n jól kimutathatók. Ezenkívül a CT és az MRI információt szolgáltathat a nehézlégzés alternatív okairól, például tüdőbetegségről vagy rekeszizombénulásról.
Diagnózis a szív képalkotáson túl:
A szívkatéterezés továbbra is az arany standard diagnosztikai vizsgálat, ha a nem invazív vizsgálat nem eredményes, a szűkület jelenlétének felmérésére és a hemodinamikai jelentőség értékelésére. Bár a legtöbb CP-s betegnél nincs szükség hemodinamikai katéterezésre a diagnózis felállításához, az egyik különös aggodalomra okot adó alcsoportot a sugárbetegségben szenvedő betegek alkotják, akiknél gyakran nehéz azonosítani a mögöttes restriktív kardiomiopátia mértékét, még akkor is, ha szűkületes jellemzők vannak jelen. Még jó minőségű echokardiográfia és szívröntgenvizsgálat mellett is szükség lehet ezeknél a betegeknél invazív hemodinamikai katéterezésre a töltőnyomás emelkedésének diasztolés kiegyenlítéssel, kamrai interdependencia és intrathoracalis-intracardialis disszociáció értékelésére.2
Kezelés:
Amikor a CP-t azonosították, a diurézissel járó gyógyszeres kezelés gyakran csak részben hatékony a tünetek enyhítésére. Ha kiterjedt pericardialis gyulladás áll fenn, a pericardiectomia elvégzése előtt indokolt a gyulladáscsökkentő terápia kipróbálása a reverzibilitás felmérése céljából. Egyes betegeknél javulhat a perikardiális compliance, ha csak átmeneti szűkületük van a gyulladás miatt.20 A CP-ben szenvedő betegeknél a tünetek enyhítésére a teljes sebészi pericardiectomia javallt. A multimodális diagnosztikai megközelítést alkalmazva (1. ábra) ma már ritkán fordul elő, hogy a betegeket a műtőbe kell vinni a CP megerősítésére. Tekintettel arra, hogy a pericardiectomia gyakran átalakítja a betegek életminőségét, a klinikusoknak továbbra is magas gyanúindexet kell fenntartaniuk a szívelégtelenség e ritka, de gyógyítható formája tekintetében.
1. ábra
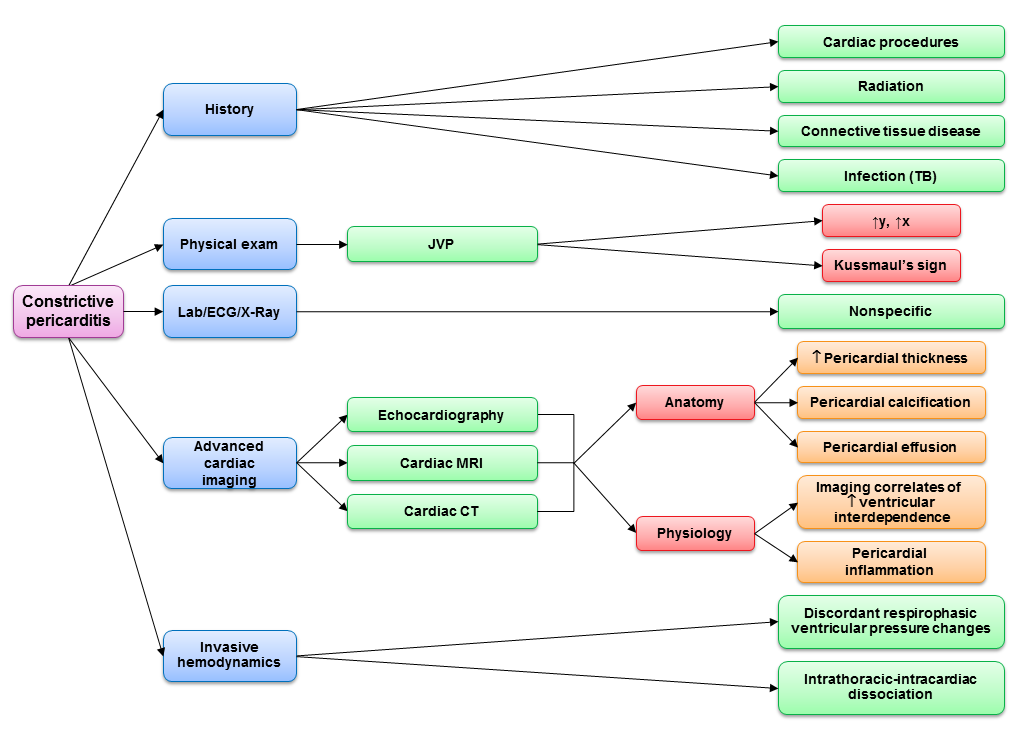
- Imazio M, Brucato A, Maestroni S, et al. Risk of constrictive pericarditis after acute pericarditis. Circulation 2011;124:1270-5.
- Geske JB, Anavekar NS, Nishimura RA, Oh JK, Gersh BJ. A szűkület és a szűkület differenciálása: komplex kardiovaszkuláris hemodinamika. J Am Coll Cardiol 2016;68:2329-47.
- Ling LH, Oh JK, Schaff HV, et al. Constrictive pericarditis in the modern era: evolving clinical spectrum and impact on outcome after pericardiectomy. Circulation 1999;100:1380-6.
- Kroeker CA, Shrive NG, Belenkie I, Tyberg JV. A pericardium modulálja a bal és jobb kamrai lökettérfogatot, hogy kompenzálja a pitvari térfogat hirtelen változásait. Am J Physiol Heart Circ Physiol 2003;284:H2247-54.
- Talreja DR, Nishimura RA, Oh JK, Holmes DR. Szűkületes pericarditis a modern korban: új diagnosztikai kritériumok a szívkatéteres laboratóriumban. J Am Coll Cardiol 2008;51:315-9.
- Sengupta PP, Krishnamoorthy VK, Abhayaratna WP, et al. Comparison of usefulness of tissue Doppler imaging versus brain natriuretic peptide for differentiation of constrictive pericardial disease from restrictive cardiomyopathy. Am J Cardiol 2008;102:357-62.
- Leya FS, Arab D, Joyal D, et al. The efficacy of brain natriuretic peptide levels in differentiating constrictive pericarditis from restrictive cardiomyopathy. J Am Coll Cardiol 2005;45:1900-2.
- Babuin L, Alegria JR, Oh JK, Nishimura RA, Jaffe AS. Agyi natriuretikus peptidszintek szűkítő pericarditisben és restriktív cardiomyopathiában. J Am Coll Cardiol 2006;47:1489-91.
- Reddy PR, Dieter RS, Das P, Steen LH, Lewis BE, Leya FS. A BNP hasznossága a szűkítő pericarditis és a restriktív cardiomyopathia megkülönböztetésében veseelégtelenségben szenvedő betegeknél. J Card Fail 2007;13:668-71.
- Welch TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic kritériumai. Circ Cardiovasc Imaging 2014;7:526-34.
- Coylewright M, Welch TD, Nishimura RA. A szeptális pattogás mechanizmusa szűkületes perikarditisben: egyidejű szívkatéteres és echokardiográfiás vizsgálat. Heart 2013;99:1376.
- Oh JK, Tajik AJ, Appleton CP, Hatle LK, Nishimura RA, Seward JB. Előterhelés-csökkentés a szűkületes pericarditis jellegzetes Doppler-jellemzőinek leleplezésére: új megfigyelés. Circulation 1997;95:796-9.
- Reuss CS, Wilansky SM, Lester SJ, et al. Using mitral ‘annulus reversus’ to diagnose constrictive pericarditis. Eur J Echocardiogr 2009;10:372-5.
- Ha JW, Oh JK, Ling LH, Nishimura RA, Seward JB, Tajik AJ. Annulus paradoxus: a transzmissziós áramlási sebesség és a mitrális gyűrűsebesség aránya fordítottan arányos a pulmonális kapilláris éknyomással szűkületes pericarditisben szenvedő betegeknél. Circulation 2001;104:976-8.
- Ha JW, Ommen SR, Tajik AJ, et al. Differentiation of constrictive pericarditis from restrictive cardiomyopathy using mitral annular velocity by tissue Doppler echocardiography. Am J Cardiol 2004;94:316-9.
- Ling LH, Oh JK, Breen JF, et al. Calcific constrictive pericarditis: is it still with us? Ann Intern Med 2000;132:444-50.
- Masui T, Finck S, Higgins CB. Szűkítő pericarditis és restriktív cardiomyopathia: értékelés MR-képalkotással. Radiology 1992;182:369-73.
- Talreja DR, Edwards WD, Danielson GK, et al. Constrictive pericarditis in 26 patients with histologically normal pericardial thickness. Circulation 2003;108:1852-7.
- Muehlberg F, Toepper A, Fritschi S, Prothmann M, Schulz-Menger J. Magnetic resonance imaging applications on infiltrative cardiomyopathies. J Thorac Imaging 2016;31:336-47.
- Haley JH, Tajik AJ, Danielson GK, Schaff HV, Mulvagh SL, Oh JK. Tranziens szűkületes pericarditis: okok és természetes lefolyás. J Am Coll Cardiol 2004;43:271-5.
Klinikai témák: Szívsebészet, szívelégtelenség és kardiomiopátiák, invazív kardiovaszkuláris angiográfia és beavatkozás, nem invazív képalkotás, perikardiális betegség, szívsebészet és szívelégtelenség, akut szívelégtelenség, krónikus szívelégtelenség, beavatkozások és képalkotás, komputertomográfia, echokardiográfia/Ultrahang, nukleáris képalkotás
Kulcsszavak: Vérnyomás, szívkatéterezés, kardiomyopátia, restriktív, diagnosztikai hibák, diagnosztikai vizsgálatok, rutin, diurézis, dyspnoe, echokardiográfia, ödéma, szívelégtelenség, szisztolés, szívkamrák, hepatikus vénák, hipovolémia, mitrális billentyű, perikardiektómia, Pericarditis, Constrictive, Pericardium, Pulmonalis ödéma, Pulmonalis vénák, Pulmonalis Wedge Pressure, Tricuspidalis billentyű, Tomográfia, X-Ray Computed, Vena Cava, Inferior, Vénás nyomás, Ventricularis nyomás, X-Rays
< Vissza a listákhoz