La péricardite constrictive (PC) est une forme relativement peu fréquente d’insuffisance cardiaque clinique. La véritable prévalence dans la population est inconnue, mais parmi les personnes atteintes de péricardite virale, on a estimé qu’elle se produisait dans moins de 0,5% des cas.1 Cependant, comme elle est potentiellement réversible, le diagnostic ne doit pas être manqué. La péricardiectomie chirurgicale a la capacité de « guérir » la PC, avec des améliorations spectaculaires des symptômes et de la qualité de vie.2,3 Bien que l’étiologie de la PC puisse être variée (idiopathique, post-virale, tuberculeuse, post-chirurgicale, radio-induite, etc.), la dernière voie commune est le développement d’un épaississement fibreux ou d’une calcification du péricarde entraînant une non-compliance péricardique.
Physiologie et pathophysiologie du péricarde dans la constriction:
Le péricarde normal entrave de façon minimale la distensibilité ventriculaire à des volumes cardiaques normaux de fonctionnement. Dans la PC, la non-conformité du péricarde crée une unité ventriculaire-péricardique rigide, entraînant une augmentation des pressions diastoliques et une élévation plus rapide des pressions ventriculaires pour un retour veineux donné. Le péricarde non conforme limite la relaxation ventriculaire et détermine la pression diastolique ventriculaire, ce qui entraîne des pressions diastoliques élevées et égalisées dans toutes les cavités. Cliniquement, cela se présente principalement comme une congestion du côté droit (distension de la veine jugulaire, œdème et ascite). L’élévation de la pression capillaire pulmonaire et la diminution de la réponse du débit cardiaque à l’effort (étant donné le remplissage ventriculaire inadéquat) entraînent une dyspnée et une intolérance à l’effort, bien que l’œdème pulmonaire franc soit moins fréquent que l’insuffisance cardiaque systolique typique.
Le péricarde normal régule le couplage des volumes d’attaque des côtés gauche et droit lors de changements aigus de la précharge, de sorte qu’une augmentation soudaine du retour veineux du côté droit (pendant l’inspiration) est associée à une courbure septale vers la gauche et à une diminution de la pression de remplissage transmurale du ventricule gauche (LV) (pression diastolique LV péricardique). Ceci diminue à son tour le volume diastolique final du VG (précharge du VG) et donc le volume systolique du côté gauche.4 Dans le cœur normal, ces changements du volume systolique avec la respiration sont minimes. Étant donné un volume péricardique fixe dans la PC, le couplage péricardique est fortement exagéré, ce qui entraîne une interdépendance ventriculaire spectaculaire. Le mouvement anormal du septum ventriculaire résulte de l’augmentation des modifications respirophasiques du volume systolique des côtés gauche et droit.
Dans la PC, le cœur étant enveloppé d’un péricarde non flexible, la diminution inspiratoire normale de la pression intrathoracique n’est pas transmise aux pressions intracardiaques. Cet effet amplifie les diminutions inspiratoires de la pression veineuse pulmonaire (puisque les veines pulmonaires sont principalement extrapéricardiques), ce qui se traduit par une réduction de la précharge inspiratoire du côté gauche, réduisant encore le volume systolique inspiratoire du côté gauche. L’évaluation diagnostique multimodale de la PC met en évidence ces résultats, facilitant ainsi le diagnostic.
Évaluation initiale :
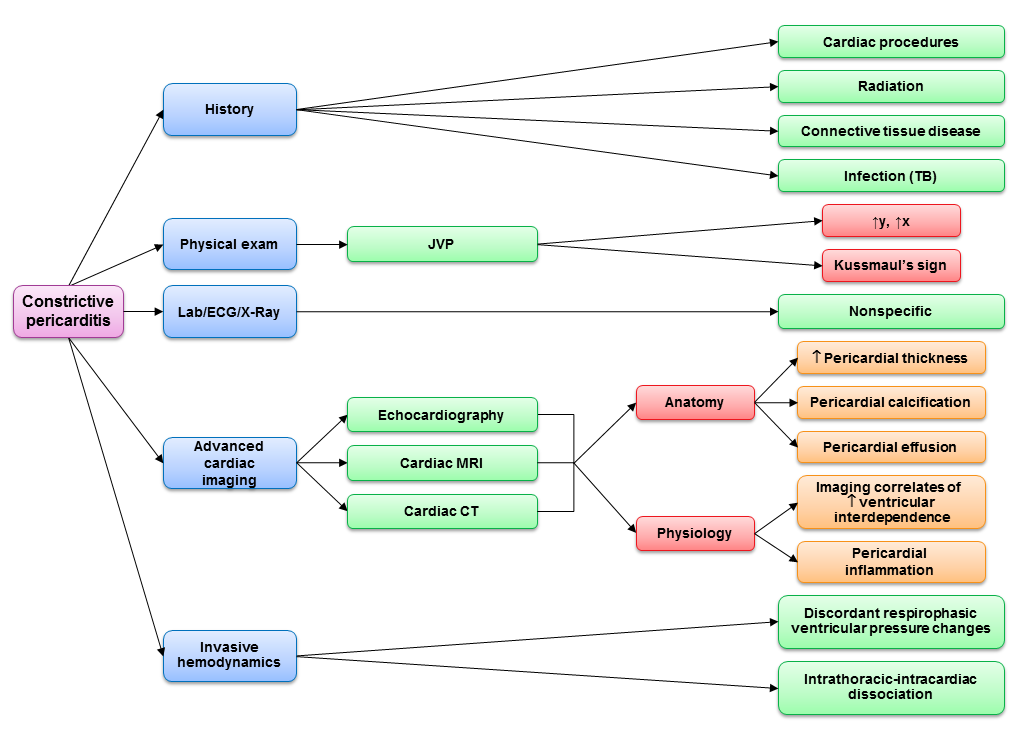
La faible prévalence de la PC fait de l’identification des caractéristiques clés de l’examen physique et de l’historique une étape initiale importante du processus diagnostique. Des antécédents de chirurgie cardiaque, de radiothérapie ou de tuberculose doivent renforcer la suspicion clinique en présence d’œdèmes, de distension abdominale et de dyspnée d’effort. Une pression veineuse jugulaire (PVJ) élevée est présente chez pratiquement tous les patients qui ne sont pas hypovolémiques. La contrainte péricardique entraîne l’incapacité du cœur droit à accueillir le retour veineux abdominal inspiratoire, ce qui se traduit par une augmentation inspiratoire de la PJV (signe de Kussmaul).5 Les descentes jugulaires en x et en y sont proéminentes dans la PC, en raison d’un mouvement annulaire longitudinal exagéré et d’un remplissage ventriculaire précoce proéminent, respectivement. En revanche, la cardiomyopathie restrictive montre un émoussement de la descente en x, dû à une relaxation auriculaire altérée et à une myopathie auriculaire. L’auscultation peut révéler un cognement péricardique aigu le long du bord sternal gauche. Une ascite et un œdème inférieur important sont fréquents et conduisent souvent à un diagnostic erroné de maladie hépatique si les résultats de la JVP ne sont pas reconnus.
Les tests de laboratoire dans la PC ne sont pas spécifiques. Un BNP élevé peut suggérer une plus grande probabilité de cardiomyopathie restrictive, mais des études ont montré un grand chevauchement des valeurs diagnostiques dans cette population, ce qui limite l’utilité clinique.6-9
Echocardiographie:
En tant que test diagnostique initial, l’échocardiographie peut confirmer le diagnostic de PC dans la plupart des cas si la probabilité pré-test est suffisamment élevée.10 L’échocardiographie démontre des caractéristiques à la fois d’interdépendance ventriculaire exagérée et de dissociation intrathoracique-intracardiaque. Le résultat pathognomonique est le déplacement septal respirophasique, détecté par le mode M ou l’imagerie 2D.5 En plus de ce mouvement septal respiratoire exagéré, il existe également un mouvement septal anormal d’un battement à l’autre, ou » shudder « , dû au remplissage diastolique précoce différentiel du ventricule droit puis du ventricule gauche.11 La veine cave inférieure est universellement pléthorique en l’absence d’hypovolémie ; une caractéristique sensible mais non spécifique de la PC. Les inversions de la veine hépatique expiratoire et la diminution du flux diastolique vers l’avant se produisent en raison d’un mouvement septal ventriculaire vers la droite dû à une augmentation expiratoire de la précharge du ventricule gauche, avec une diminution résultante de la compliance efficace du ventricule droit.
Les changements exagérés de la précharge respiratoire sont également illustrés par une diminution inspiratoire du Doppler du flux d’entrée de la valve mitrale et une augmentation du Doppler du flux d’entrée de la valve tricuspide. Cependant, ces résultats ne sont pas sensibles. En présence d’une augmentation significative des pressions cunéiformes de l’oreillette gauche et des capillaires pulmonaires, la diminution du gradient pression cunéiforme-LV lors de l’inspiration est insuffisante pour modifier suffisamment la précharge du ventricule gauche pour modifier l’amplitude du Doppler du flux d’entrée mitral12. En raison de l’attachement à la paroi latérale, la vitesse Doppler tissulaire diastolique précoce de l’anneau mitral latéral (e’) est souvent réduite et anormalement inférieure à la vitesse e’ médiale (annulus reversus).13 Contrairement aux causes cardiomyopathiques de l’insuffisance cardiaque, la vitesse e’ médiale est relativement normale (ou même augmentée, appelée annulus paradoxus) étant donné la relaxation myocardique normale et le mouvement longitudinal annulaire médial compensatoire dans le cadre de l’attachement à la paroi latérale.14,15
Radiologie cardiaque:
Dans la PC, les radiographies du thorax peuvent démontrer une calcification péricardique, un résultat pathognomonique en présence d’une insuffisance cardiaque clinique et d’une PJV élevée. Le scanner thoracique est plus sensible pour la calcification péricardique que la radiographie thoracique.16 Le scanner thoracique et l’IRM permettent une mesure précise de l’épaisseur du péricarde, l’IRM en particulier démontrant une excellente précision (93%) dans la détection d’un épaississement péricardique >4 mm.17 Cependant, il est important de se rappeler que jusqu’à 18% des cas de PC confirmée chirurgicalement peuvent avoir une épaisseur péricardique normale malgré une non-conformité pathologique.18 L’accrochage péricardique, qui peut être visualisé par échocardiographie, CT ou IRM, peut également donner un aperçu de la présence d’une PC. L’IRM donne des informations sur l’inflammation péricardique active, ce qui peut aider à guider les décisions thérapeutiques. De plus, l’IRM cardiaque fournit une évaluation unique du myocarde, qui peut identifier des processus cardiomyopathiques lorsque le diagnostic est incertain. Le rehaussement différé du myocarde est généralement absent en cas de PC isolée, mais il peut être présent dans près d’un tiers des cas de cardiomyopathie restrictive.19
Contrairement à l’échocardiographie, la TDM et l’IRM cardiaques ne dépendent pas de l’habitus du patient et peuvent fournir une meilleure visualisation cardiaque lorsque l’imagerie échocardiographique est sous-optimale. Les déplacements respirophasiques du septum sont bien mis en évidence par la TDM et l’IRM. En outre, le CT et l’IRM peuvent fournir des informations sur les causes alternatives de la dyspnée, telles que les maladies pulmonaires ou la paralysie diaphragmatique.
Diagnostic au-delà de l’imagerie cardiaque :
Le cathétérisme cardiaque reste le test diagnostique de référence, si les tests non invasifs ne sont pas concluants, pour évaluer la présence de la constriction et évaluer la signification hémodynamique. Si la plupart des patients atteints de PC ne nécessitent pas de cathétérisme hémodynamique pour le diagnostic, un sous-groupe particulièrement préoccupant est celui des patients atteints de cardiopathie radique, chez qui il est souvent difficile d’identifier le degré de cardiomyopathie restrictive sous-jacente, même si des caractéristiques constrictives sont présentes. Même avec une échocardiographie et une radiologie cardiaque de haute qualité, ces patients peuvent nécessiter un cathétérisme hémodynamique invasif pour évaluer l’élévation des pressions de remplissage avec égalisation diastolique, l’interdépendance ventriculaire et la dissociation intrathoracique-intracardique.2
Traitement:
Une fois la PC identifiée, le traitement médical avec diurèse n’est souvent que partiellement efficace pour pallier les symptômes. En cas d’inflammation péricardique étendue, un essai de traitement anti-inflammatoire est justifié pour évaluer la réversibilité avant de procéder à la péricardiectomie. Certains patients peuvent présenter une amélioration de la compliance péricardique s’ils ne présentent qu’une constriction transitoire due à l’inflammation.20 La péricardiectomie chirurgicale complète est indiquée pour soulager les symptômes des patients atteints de PC. En utilisant une approche diagnostique multimodale (Figure 1), il est maintenant rare que les patients passent au bloc opératoire pour confirmer la PC. Compte tenu du caractère souvent transformateur de la péricardiectomie pour la qualité de vie des patients, les cliniciens doivent continuer à maintenir un indice de suspicion élevé pour cette forme rare mais curable d’insuffisance cardiaque.
Figure 1
- Imazio M, Brucato A, Maestroni S, et al. Risque de péricardite constrictive après une péricardite aiguë. Circulation 2011;124:1270-5.
- Geske JB, Anavekar NS, Nishimura RA, Oh JK, Gersh BJ. Différenciation de la constriction et de la restriction : hémodynamique cardiovasculaire complexe. J Am Coll Cardiol 2016;68:2329-47.
- Ling LH, Oh JK, Schaff HV, et al. Constrictive pericarditis in the modern era : evolving clinical spectrum and impact on outcome after pericardiectomy. Circulation 1999;100:1380-6.
- Kroeker CA, Shrive NG, Belenkie I, Tyberg JV. Le péricarde module les volumes d’attaque ventriculaires gauche et droit pour compenser les changements soudains du volume auriculaire. Am J Physiol Heart Circ Physiol 2003;284:H2247-54.
- Talreja DR, Nishimura RA, Oh JK, Holmes DR. La péricardite constrictive à l’ère moderne : nouveaux critères de diagnostic dans le laboratoire de cathétérisme cardiaque. J Am Coll Cardiol 2008;51:315-9.
- Sengupta PP, Krishnamoorthy VK, Abhayaratna WP, et al. Comparaison de l’utilité de l’imagerie Doppler tissulaire par rapport au peptide natriurétique cérébral pour différencier la maladie péricardique constrictive de la cardiomyopathie restrictive. Am J Cardiol 2008;102:357-62.
- Leya FS, Arab D, Joyal D, et al. L’efficacité des taux de peptide natriurétique cérébral pour différencier la péricardite constrictive de la cardiomyopathie restrictive. J Am Coll Cardiol 2005;45:1900-2.
- Babuin L, Alegria JR, Oh JK, Nishimura RA, Jaffe AS. Niveaux de peptide natriurétique cérébral dans la péricardite constrictive et la cardiomyopathie restrictive. J Am Coll Cardiol 2006;47:1489-91.
- Reddy PR, Dieter RS, Das P, Steen LH, Lewis BE, Leya FS. Utilité du BNP pour différencier la péricardite constrictive de la cardiomyopathie restrictive chez les patients souffrant d’insuffisance rénale. J Card Fail 2007;13:668-71.
- Welch TD, Ling LH, Espinosa RE, et al. Diagnostic échocardiographique de la péricardite constrictive : Les critères de la Clinique Mayo. Circ Cardiovasc Imaging 2014;7:526-34.
- Coylewright M, Welch TD, Nishimura RA. Mécanisme du rebondissement septal dans la péricardite constrictive : une étude simultanée par cathétérisme cardiaque et échocardiographie. Heart 2013;99:1376.
- Oh JK, Tajik AJ, Appleton CP, Hatle LK, Nishimura RA, Seward JB. Réduction de la précharge pour démasquer les caractéristiques Doppler de la péricardite constrictive : une nouvelle observation. Circulation 1997;95:796-9.
- Reuss CS, Wilansky SM, Lester SJ, et al. Using mitral ‘annulus reversus’ to diagnose constrictive pericarditis. Eur J Echocardiogr 2009;10:372-5.
- Ha JW, Oh JK, Ling LH, Nishimura RA, Seward JB, Tajik AJ. Annulus paradoxus : le rapport entre la vitesse du flux transmitral et la vitesse de l’anneau mitral est inversement proportionnel à la pression capillaire pulmonaire dans les patients atteints de péricardite constrictive. Circulation 2001;104:976-8.
- Ha JW, Ommen SR, Tajik AJ, et al. Differentiation of constrictive pericarditis from restrictive cardiomyopathy using mitral annular velocity by tissue Doppler echocardiography. Am J Cardiol 2004;94:316-9.
- Ling LH, Oh JK, Breen JF, et al. Calcific constrictive pericarditis : is it still with us ? Ann Intern Med 2000;132:444-50.
- Masui T, Finck S, Higgins CB. Péricardite constrictive et cardiomyopathie restrictive : évaluation par imagerie RM. Radiology 1992;182:369-73.
- Talreja DR, Edwards WD, Danielson GK, et al. Constrictive pericarditis in 26 patients with histologically normal pericardial thickness. Circulation 2003;108:1852-7.
- Muehlberg F, Toepper A, Fritschi S, Prothmann M, Schulz-Menger J. Applications de l’imagerie par résonance magnétique sur les cardiomyopathies infiltrantes. J Thorac Imaging 2016;31:336-47.
- Haley JH, Tajik AJ, Danielson GK, Schaff HV, Mulvagh SL, Oh JK. Péricardite constrictive transitoire : causes et histoire naturelle. J Am Coll Cardiol 2004;43:271-5.
Thèmes cliniques : Chirurgie cardiaque, insuffisance cardiaque et cardiomyopathies, angiographie et intervention cardiovasculaire invasive, imagerie non invasive, maladie péricardique, chirurgie cardiaque et insuffisance cardiaque, insuffisance cardiaque aiguë, insuffisance cardiaque chronique, interventions et imagerie, tomodensitométrie, échocardiographie/échographie, imagerie nucléaire
Mots-clés : Pression artérielle, Cathétérisme cardiaque, Cardiomyopathie, Restrictive, Erreurs de diagnostic, Tests de diagnostic, Routine, Diurèse, Dyspnée, Echocardiographie, Œdème, Insuffisance cardiaque, Systolique, Ventricules cardiaques, Veines hépatiques, Hypovolémie, Valve mitrale, Péricardiectomie, Péricardite constrictive, péricarde, œdème pulmonaire, veines pulmonaires, pression du coin pulmonaire, valve tricuspide, tomographie à rayons X, veine cave inférieure, pression veineuse, pression ventriculaire, rayons X
< Retour aux listes
.