Zaciskające zapalenie osierdzia (CP) jest stosunkowo rzadką postacią kliniczną niewydolności serca. Prawdziwa częstość występowania w populacji nie jest znana, ale szacuje się, że wśród chorych z wirusowym zapaleniem osierdzia występuje ono w mniej niż 0,5% przypadków.1 Ponieważ jednak jest to choroba potencjalnie odwracalna, nie wolno jej przeoczyć. Chirurgiczna perikardiektomia jest w stanie „wyleczyć” CP, z radykalną poprawą objawów i jakości życia.2,3 Chociaż etiologia CP może być różna (idiopatyczna, po wirusowa, gruźlicza, pooperacyjna, spowodowana promieniowaniem itp.), ostateczną wspólną drogą jest rozwój włóknistego zgrubienia lub zwapnienia osierdzia skutkującego niezgodnością osierdzia.
Fizjologia i patofizjologia osierdzia w zwężeniu:
Prawidłowe osierdzie minimalnie utrudnia rozciągliwość komór przy normalnej objętości operacyjnej serca. W CP, osierdziowa niezgodność tworzy sztywną komorowo-osierdziową jednostkę, prowadząc do zwiększonych rozkurczowych ciśnień i szybszego wzrostu w komorowych ciśnieniach dla danego żylnego powrotu. Niekompatybilne osierdzie ogranicza relaksację komór i determinuje ciśnienie rozkurczowe w komorach, co skutkuje podwyższonym, wyrównanym ciśnieniem rozkurczowym we wszystkich komorach. Klinicznie objawia się to głównie jako prawostronne przekrwienie (poszerzenie żył szyjnych, obrzęk i wodobrzusze). Podwyższenie ciśnienia zaklinowania w kapilarach płucnych i zmniejszenie rzutu serca w odpowiedzi na wysiłek (z powodu nieodpowiedniego napełniania komór) powoduje duszność i nietolerancję wysiłku, chociaż prawdziwy obrzęk płuc występuje rzadziej niż w typowej skurczowej niewydolności serca.
Normalne osierdzie reguluje sprzężenie lewostronnej i prawostronnej objętości wyrzutowej podczas ostrych zmian obciążenia wstępnego, tak że nagły wzrost prawostronnego powrotu żylnego (podczas wdechu) jest związany z lewostronnym wygięciem przegrody i zmniejszeniem ciśnienia napełniania transmuralnego lewej komory (LV) (ciśnienie rozkurczowe LV przez osierdzie). To z kolei zmniejsza objętość końcoworozkurczową LV (obciążenie wstępne LV), a tym samym objętość wyrzutową lewej komory.4 W prawidłowym sercu te zmiany objętości wyrzutowej wraz z oddychaniem są minimalne. Biorąc pod uwagę stałą objętość osierdzia w CP, sprzężenie osierdziowe jest znacznie wyolbrzymione, co prowadzi do dramatycznej współzależności między komorami. Nieprawidłowy ruch przegrody międzykomorowej wynika z nasilonych zmian respirofazy w lewostronnej i prawostronnej objętości wyrzutowej.
W CP, ze względu na to, że serce jest otoczone przez nieelastyczne osierdzie, normalny wdechowy spadek ciśnienia wewnątrzklatkowego nie jest przenoszony na ciśnienie wewnątrzsercowe. Efekt ten potęguje wdechowe obniżenie ciśnienia w żyłach płucnych (ponieważ żyły płucne znajdują się głównie poza osierdziem), co przekłada się na zmniejszenie lewostronnego wdechowego obciążenia wstępnego i dalsze zmniejszenie lewostronnej wdechowej objętości wyrzutowej. Multimodalna ocena diagnostyczna CP uwydatnia te wyniki, ułatwiając rozpoznanie.
Ocena wstępna:
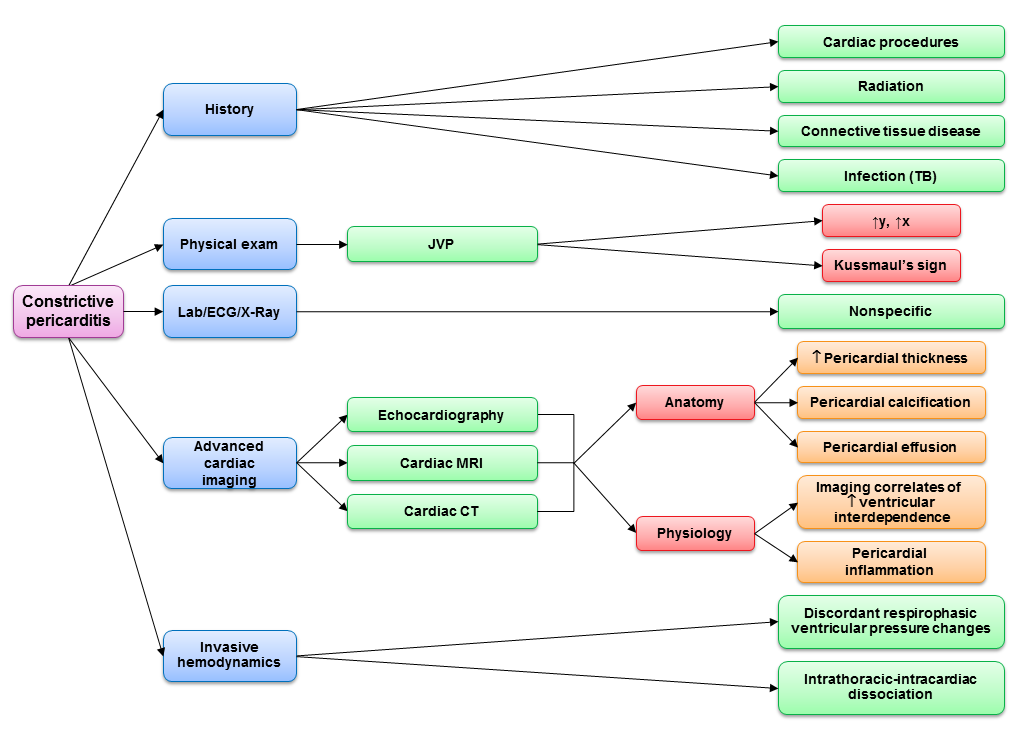
Niska częstość występowania CP sprawia, że identyfikacja kluczowych cech badania fizykalnego i danych historycznych jest ważnym początkowym krokiem w procesie diagnostycznym. Historia operacji serca, napromieniania lub gruźlicy powinna zwiększyć kliniczne podejrzenie w obecności obrzęku, rozdęcia brzucha i duszności wysiłkowej. Podwyższone szyjne ciśnienie żylne (JVP) występuje praktycznie u wszystkich pacjentów, którzy nie są hipowolemiczni. Ograniczenie osierdzia powoduje, że prawe serce nie jest w stanie przyjąć wdechowego powrotu żylnego z jamy brzusznej, co przekłada się na wdechowy wzrost JVP (objaw Kussmaula).5 Zstępy szyjne x i y są wyraźne w CP, co wynika odpowiednio z przesadnego podłużnego ruchu pierścieni i znacznego wczesnego napełniania komór. Z kolei w kardiomiopatii restrykcyjnej z powodu upośledzonej relaksacji przedsionków i miopatii przedsionkowej obserwuje się stępienie zstępowania x. Osłuchiwanie może ujawnić głośny stukot osierdzia wzdłuż lewej granicy mostka. Wodobrzusze i znaczny obrzęk dolnej części ciała są częste i często prowadzą do błędnego rozpoznania choroby wątroby, jeśli wyniki JVP nie są rozpoznawane.
Badania laboratoryjne w CP są niespecyficzne. Wysokie stężenie BNP może sugerować większe prawdopodobieństwo kardiomiopatii restrykcyjnej, ale badania wykazały duże nakładanie się wartości diagnostycznych w tej populacji, co ogranicza przydatność kliniczną.6-9
Echokardiografia:
Jako wstępne badanie diagnostyczne, echokardiografia może potwierdzić rozpoznanie CP w większości przypadków, jeśli prawdopodobieństwo przed badaniem jest wystarczająco duże.10 Echokardiografia wykazuje cechy zarówno przesadnej współzależności międzykomorowej, jak i dysocjacji wewnątrzklatkowo-wewnątrzsercowej. Patognomonicznym objawem jest respirofazowe przesunięcie przegrody międzykomorowej, wykrywane zarówno w trybie M, jak i w obrazowaniu 2D.5 Poza tym przesadnym ruchem przegrody międzykomorowej występuje również nieprawidłowy ruch przegrody między uderzeniami serca, czyli „dreszcze”, spowodowane różnym szybkim napełnianiem wczesnorozkurczowym prawej, a następnie lewej komory.11 Żyła główna dolna jest powszechnie opłucnowa przy braku hipowolemii; jest to czuła, ale niespecyficzna cecha CP. Wydechowe odwrócenie żył wątrobowych i zmniejszony rozkurczowy przepływ naprzód zdarzają się z powodu prawostronnego ruchu przegrody międzykomorowej od wydechowego wzrostu obciążenia wstępnego LV, z wynikającym zmniejszeniem efektywnej operacyjnej podatności prawej komory.
Wyolbrzymione oddechowe zmiany obciążenia wstępnego są również egzemplifikowane przez wdechowy spadek dopplerowskiego napływu zastawki mitralnej i wzrost dopplerowskiego napływu zastawki trójdzielnej. Wyniki te są jednak mało czułe. W obecności istotnie zwiększonego ciśnienia zaklinowania w lewym przedsionku i kapilarach płucnych spadek gradientu ciśnienie zaklinowania-LV przy wdechu jest niewystarczający do zmiany obciążenia wstępnego LV na tyle, aby zmienić wielkość dopplerowskiego napływu mitralnego.12 Ze względu na uwięźnięcie ściany bocznej boczna prędkość wczesnorozkurczowa tkankowego Dopplera mitralnego (e’) jest często zmniejszona i nieprawidłowo niższa niż prędkość e’ przyśrodkowa (annulus reversus).13 W przeciwieństwie do kardiomiopatycznych przyczyn niewydolności serca, przyśrodkowa prędkość e’ jest względnie prawidłowa (lub nawet zwiększona, tzw. paradoxus annulus), biorąc pod uwagę prawidłową relaksację mięśnia sercowego i kompensacyjny ruch wzdłużny pierścienia przyśrodkowego w warunkach uwięźnięcia ściany bocznej.14,15
Radiologia kardiologiczna:
W CP badanie RTG klatki piersiowej może wykazać zwapnienie osierdzia, co jest patognomonicznym objawem w obecności klinicznej niewydolności serca i podwyższonego JVP. Tomografia komputerowa klatki piersiowej jest bardziej czuła na zwapnienie osierdzia niż RTG klatki piersiowej.16 Tomografia komputerowa klatki piersiowej i rezonans magnetyczny pozwalają na precyzyjny pomiar grubości osierdzia, przy czym w szczególności rezonans magnetyczny wykazuje doskonałą dokładność (93%) w wykrywaniu pogrubienia osierdzia >4 mm.17 Należy jednak pamiętać, że nawet w 18% przypadków potwierdzonej chirurgicznie CP może występować prawidłowa grubość osierdzia mimo patologicznej niezgodności.18 Wgląd w obecność CP może również zapewnić uwiązanie osierdzia, które można uwidocznić za pomocą echokardiografii, TK lub MRI. Rezonans magnetyczny dostarcza informacji o aktywnym zapaleniu osierdzia, co może pomóc w podejmowaniu decyzji terapeutycznych. Ponadto, MRI serca zapewnia unikalną ocenę mięśnia sercowego, co może pomóc w identyfikacji procesów kardiomiopatycznych, gdy diagnoza jest niepewna. Opóźnione wzmocnienie mięśnia sercowego jest zwykle nieobecne w izolowanej CP, ale może występować w prawie jednej trzeciej przypadków z kardiomiopatią restrykcyjną.19
W przeciwieństwie do echokardiografii, TK serca i MRI nie zależą od budowy ciała pacjenta i mogą zapewnić lepszą wizualizację serca, gdy obrazowanie echokardiograficzne jest suboptymalne. Respiratorowe przesunięcia w ruchu przegrody międzykomorowej są dobrze widoczne zarówno w CT, jak i MRI. Ponadto CT i MRI mogą dostarczyć informacji o alternatywnych przyczynach duszności, takich jak choroby płuc lub porażenie przepony.
Diagnostyka poza obrazowaniem serca:
Cewnikowanie serca pozostaje złotym standardem diagnostycznym, jeśli badania nieinwazyjne są niejednoznaczne, aby ocenić obecność zwężenia i ocenić znaczenie hemodynamiczne. Chociaż większość pacjentów z CP nie wymaga cewnikowania hemodynamicznego w celu postawienia diagnozy, jedną podgrupą, która budzi szczególne obawy, są pacjenci z radiologiczną chorobą serca, u których często trudno jest określić stopień podstawowej kardiomiopatii restrykcyjnej, nawet jeśli obecne są cechy zwężenia. Nawet przy wysokiej jakości badaniach echokardiograficznych i radiologicznych serca pacjenci ci mogą wymagać inwazyjnego cewnikowania hemodynamicznego w celu oceny podwyższenia ciśnienia napełniania z wyrównaniem rozkurczowym, współzależności międzykomorowej i dysocjacji wewnątrzklatkowej.2
Leczenie:
Po rozpoznaniu CP leczenie farmakologiczne z diurezą jest często tylko częściowo skuteczne w łagodzeniu objawów. Jeśli występuje rozległe zapalenie osierdzia, uzasadnione jest przeprowadzenie próby leczenia przeciwzapalnego w celu oceny odwracalności objawów przed przystąpieniem do zabiegu perikardiektomii. U niektórych pacjentów może nastąpić poprawa podatności osierdzia, jeśli mają oni tylko przejściowe zwężenie spowodowane zapaleniem.20 Chirurgiczna całkowita perikardiektomia jest wskazana w celu złagodzenia objawów u pacjentów z CP. Dzięki zastosowaniu wielomodalnej diagnostyki (ryc. 1), obecnie rzadko zdarza się, aby pacjenci byli kierowani na salę operacyjną w celu potwierdzenia CP. Biorąc pod uwagę często zmieniający się charakter perikardiektomii dla jakości życia pacjentów, klinicyści muszą nadal utrzymywać wysoki indeks podejrzliwości w odniesieniu do tej rzadkiej, ale uleczalnej postaci niewydolności serca.
Rycina 1
- Imazio M, Brucato A, Maestroni S, et al. Risk of constrictive pericarditis after acute pericarditis. Circulation 2011;124:1270-5.
- Geske JB, Anavekar NS, Nishimura RA, Oh JK, Gersh BJ. Differentiation of constriction and restriction: complex cardiovascular hemodynamics. J Am Coll Cardiol 2016;68:2329-47.
- Ling LH, Oh JK, Schaff HV, et al. Constrictive pericarditis in the modern era: evolving clinical spectrum and impact on outcome after pericardiectomy. Circulation 1999;100:1380-6.
- Kroeker CA, Shrive NG, Belenkie I, Tyberg JV. Pericardium modulates left and right ventricular stroke volumes to compensate for sudden changes in atrial volume. Am J Physiol Heart Circ Physiol 2003;284:H2247-54.
- Talreja DR, Nishimura RA, Oh JK, Holmes DR. Constrictive pericarditis in the modern era: novel criteria for diagnosis in the cardiac catheterization laboratory. J Am Coll Cardiol 2008;51:315-9.
- Sengupta PP, Krishnamoorthy VK, Abhayaratna WP, et al. Comparison of usefulness of tissue Doppler imaging versus brain natriuretic peptide for differentiation of constrictive pericardial disease from restrictive cardiomyopathy. Am J Cardiol 2008;102:357-62.
- Leya FS, Arab D, Joyal D, et al. The efficacy of brain natriuretic peptide levels in differentiating constrictive pericardialitis from restrictive cardiomyopathy. J Am Coll Cardiol 2005;45:1900-2.
- Babuin L, Alegria JR, Oh JK, Nishimura RA, Jaffe AS. Brain natriuretic peptide levels in constrictive pericarditis and restrictive cardiomyopathy. J Am Coll Cardiol 2006;47:1489-91.
- Reddy PR, Dieter RS, Das P, Steen LH, Lewis BE, Leya FS. Utility of BNP in differentiating constrictive pericarditis from restrictive cardiomyopathy in patients with renal insufficiency. J Card Fail 2007;13:668-71.
- Welch TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc Imaging 2014;7:526-34.
- Coylewright M, Welch TD, Nishimura RA. Mechanizm odbicia przegrody międzykomorowej w zaciskającym zapaleniu osierdzia: jednoczesne badanie cewnikowania serca i echokardiograficzne. Heart 2013;99:1376.
- Oh JK, Tajik AJ, Appleton CP, Hatle LK, Nishimura RA, Seward JB. Preload reduction to unmask the characteristic Doppler features of constrictive pericarditis: a new observation. Circulation 1997;95:796-9.
- Reuss CS, Wilansky SM, Lester SJ, et al. Using mitral 'annulus reversus’ to diagnose constrictive pericarditis. Eur J Echocardiogr 2009;10:372-5.
- Ha JW, Oh JK, Ling LH, Nishimura RA, Seward JB, Tajik AJ. Annulus paradoxus: transmitral flow velocity to mitral annocity ratio is inversersely proportional to pulmonary capillary wedge pressure in patients with constrictive pericarditis. Circulation 2001;104:976-8.
- Ha JW, Ommen SR, Tajik AJ, et al. Differentiation of constrictive pericarditis from restrictive cardiomyopathy using mitral annular velocity by tissue Doppler echocardiography. Am J Cardiol 2004;94:316-9.
- Ling LH, Oh JK, Breen JF, et al. Calcific constrictive pericarditis: is it still with us? Ann Intern Med 2000;132:444-50.
- Masui T, Finck S, Higgins CB. Constrictive pericarditis and restrictive cardiomyopathy: evaluation with MR imaging. Radiology 1992;182:369-73.
- Talreja DR, Edwards WD, Danielson GK, et al. Constrictive pericarditis in 26 patients with histologically normal pericardial thickness. Circulation 2003;108:1852-7.
- Muehlberg F, Toepper A, Fritschi S, Prothmann M, Schulz-Menger J. Magnetic resonance imaging applications on infiltrative cardiomyopathies. J Thorac Imaging 2016;31:336-47.
- Haley JH, Tajik AJ, Danielson GK, Schaff HV, Mulvagh SL, Oh JK. Transient constrictive pericarditis: causes and natural history. J Am Coll Cardiol 2004;43:271-5.
Clinical Topics: Kardiochirurgia, Niewydolność serca i kardiomiopatie, Inwazyjna angiografia sercowo-naczyniowa i interwencje, Nieinwazyjne obrazowanie, Choroba osierdzia, Kardiochirurgia i niewydolność serca, Ostra niewydolność serca, Przewlekła niewydolność serca, Interwencje i obrazowanie, Tomografia komputerowa, Echokardiografia/Ultrasonografia, Obrazowanie jądrowe
Słowa kluczowe: Blood Pressure, Cardiac Catheterization, Cardiomyopathy, Restrictive, Diagnostic Errors, Diagnostic Tests, Routine, Diuresis, Dyspnea, Echocardiography, Edema, Heart Failure, Systolic, Heart Ventricles, Hepatic Veins, Hypovolemia, Mitral Valve, Pericardiectomy, Pericarditis, Constrictive, Pericardium, Pulmonary Edema, Pulmonary Veins, Pulmonary Wedge Pressure, Tricuspid Valve, Tomography, X-Ray Computed, Vena Cava, Inferior, Venous Pressure, Ventricular Pressure, X-Rays
< Powrót do notowań
.