Lernziele
- Einfache (geradkettige) Alkane anhand von Formeln identifizieren und benennen und Formeln für geradkettige Alkane anhand ihrer Namen schreiben.
Wir beginnen unser Studium der organischen Chemie mit den Kohlenwasserstoffen, den einfachsten organischen Verbindungen, die nur aus Kohlenstoff- und Wasserstoffatomen bestehen. Wie wir bereits festgestellt haben, gibt es verschiedene Arten von Kohlenwasserstoffen. Sie unterscheiden sich durch die Art der Bindung zwischen den Kohlenstoffatomen und die Eigenschaften, die sich aus dieser Bindung ergeben. Kohlenwasserstoffe, die nur Kohlenstoff-Kohlenstoff-Einfachbindungen (C-C) aufweisen und als kontinuierliche Kette von Kohlenstoffatomen bestehen, die auch an Wasserstoffatome gebunden sind, werden als Alkane (oder gesättigte Kohlenwasserstoffe) bezeichnet. Gesättigt bedeutet in diesem Fall, dass jedes Kohlenstoffatom an vier andere Atome (Wasserstoff oder Kohlenstoff) gebunden ist – so viele wie möglich; es gibt keine Doppel- oder Dreifachbindungen in den Molekülen.
Das Wort gesättigt hat für Kohlenwasserstoffe dieselbe Bedeutung wie für die Nahrungsfette und -öle: Das Molekül hat keine Kohlenstoff-Kohlenstoff-Doppelbindungen (C=C).
Wir haben bereits die drei einfachsten Alkane – Methan (CH4), Ethan (C2H6) und Propan (C3H8) – vorgestellt, und sie sind in Abbildung \(\PageIndex{1}\) nochmals dargestellt.
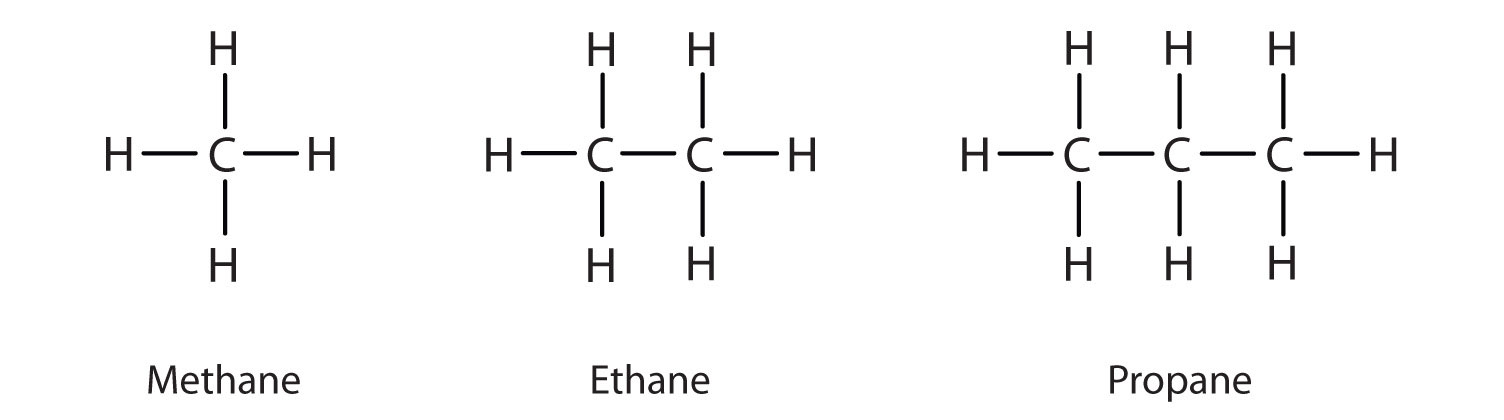
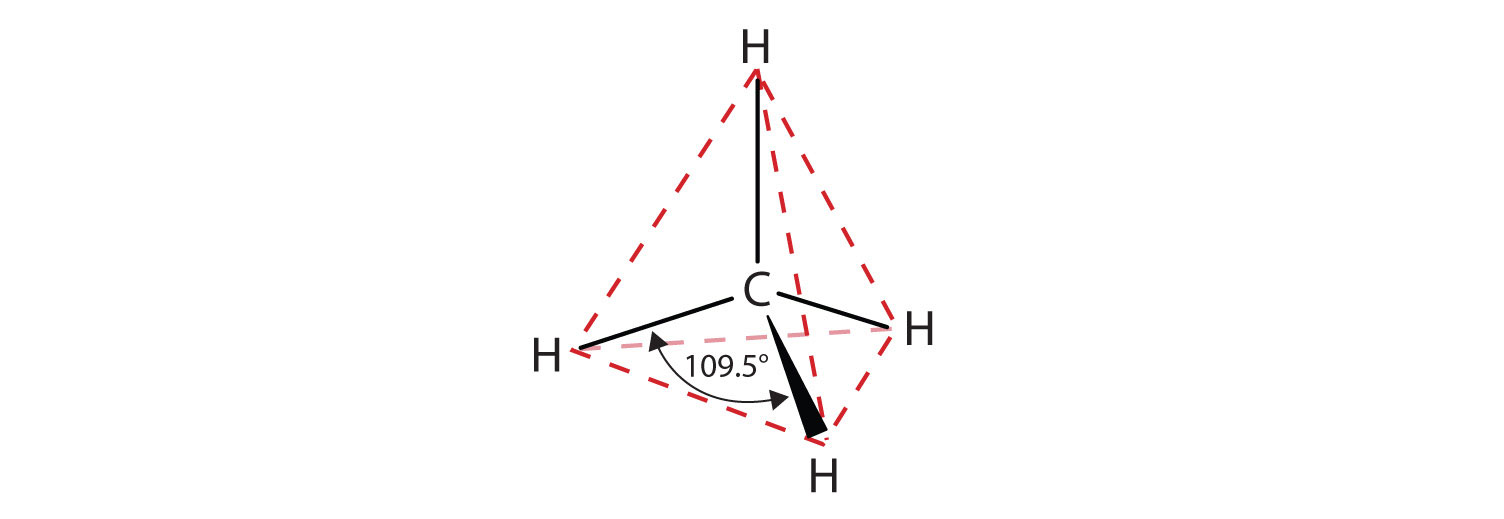
Die gezeigten flachen Darstellungen geben die Bindungswinkel oder die Molekülgeometrie nicht genau wieder. Methan hat eine tetraedrische Form, die Chemiker oft mit Keilen darstellen, die Bindungen anzeigen, die auf den Betrachter zukommen, und mit gestrichelten Linien, die Bindungen anzeigen, die von ihm weggehen. Eine gewöhnliche durchgezogene Linie zeigt eine Bindung in der Ebene der Seite an. Erinnern Sie sich daran, dass die VSEPR-Theorie eine tetraedrische Form für das Methanmolekül korrekt vorhersagt (Abbildung \(\PageIndex{2}\)).
Methan (CH4), Ethan (C2H6) und Propan (C3H8) stehen am Anfang einer Reihe von Verbindungen, bei denen sich zwei beliebige Mitglieder in einer Folge durch ein Kohlenstoffatom und zwei Wasserstoffatome unterscheiden, also eine CH2-Einheit. Die ersten 10 Mitglieder dieser Reihe sind in Tabelle \(\PageIndex{1}\) aufgeführt.
| Name | Molekulare Formel (CnH2n + 2) | Kondensierte Strukturformel | Anzahl der Möglicher Isomere |
|---|---|---|---|
| Methan | CH4 | – | |
| Ethan | C2H6 | CH3CH3 | – |
| Propan | C3H8 | CH3CH2CH3 | – |
| Butan | C4H10 | CH3CH2CH2CH3 | 2 |
| Pentan | C5H12 | CH3CH2CH2CH2CH3 | 3 |
| Hexan | C6H14 | CH3CH2CH2CH2CH3 | 5 |
| Heptan | C7H16 | CH3CH2CH2CH2CH2CH2CH3 | 9 |
| Oktan | C8H18 | CH3CH2CH2CH2CH2CH2CH3 | 18 |
| Nonan | C9H20 | CH3CH2CH2CH2CH2CH2CH2CH2CH3 | 35 |
| Decan | C10H22 | CH3CH2CH2CH2CH2CH2CH2CH2CH3 | 75 |
Betrachten Sie die Reihe in Abbildung \(\PageIndex{3}\). Die Reihe beginnt mit C3H8, und bei jedem Schritt in der Reihe wird eine CH2-Einheit hinzugefügt. Jede Familie von Verbindungen, in der sich benachbarte Mitglieder durch einen bestimmten Faktor (hier eine CH2-Gruppe) voneinander unterscheiden, wird als homologe Reihe bezeichnet. Die Mitglieder einer solchen Reihe, die als Homologe bezeichnet werden, haben Eigenschaften, die in regelmäßiger und vorhersehbarer Weise variieren. Das Prinzip der Homologie gibt der organischen Chemie eine ähnliche Struktur, wie das Periodensystem der anorganischen Chemie eine Struktur gibt. Anstelle einer verwirrenden Reihe von einzelnen Kohlenstoffverbindungen können wir einige Mitglieder einer homologen Reihe untersuchen und von ihnen einige der Eigenschaften anderer Verbindungen in der Reihe ableiten.
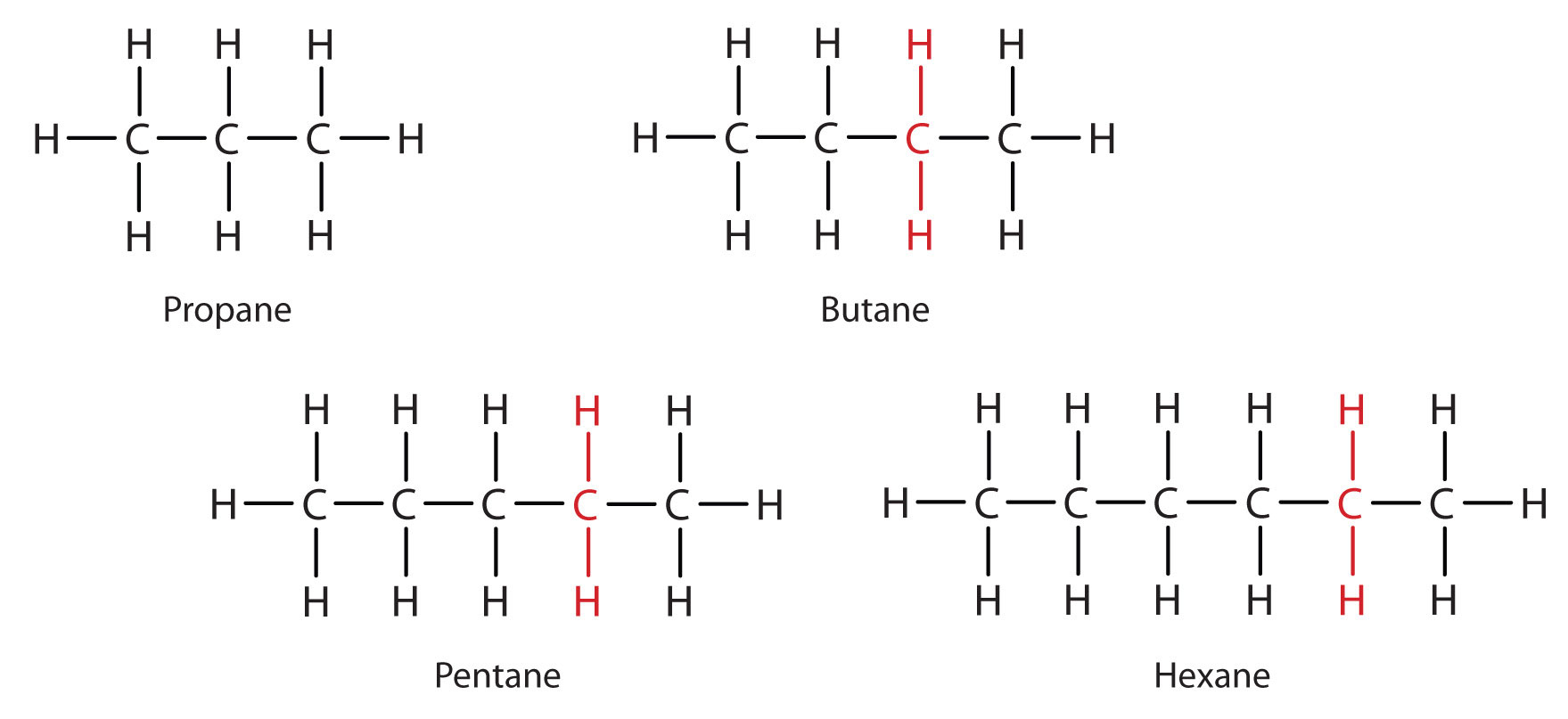
Das Prinzip der Homologie erlaubt es uns, eine allgemeine Formel für Alkane zu schreiben: CnH2n + 2. Mit dieser Formel kann man für jedes Alkan mit einer bestimmten Anzahl von Kohlenstoffatomen eine Summenformel schreiben. Ein Alkan mit acht Kohlenstoffatomen hat zum Beispiel die Summenformel C8H(2 × 8) + 2 = C8H18.
Key Takeaway
- Einfache Alkane existieren als homologe Reihen, in denen sich benachbarte Mitglieder durch eine CH2-Einheit unterscheiden.