Der vorangegangene Abschnitt zeigt, wie verschiedene Elemente entweder allein existieren oder sich mit anderen Elementen verbinden können, um Verbindungen herzustellen. Dieser Abschnitt baut auf diesen Ideen auf, indem er die chemischen Reaktionen genauer betrachtet. Er zeigt auch, wie die chemische Kurzschrift auf die Beschreibung chemischer Reaktionen ausgedehnt werden kann.
Betrachten wir zunächst einige der zuvor beschriebenen Moleküle: Wasser, Methan, Kohlendioxid und Ammoniak.
Frage 26
Wie lauten die Formeln für jedes dieser vier Moleküle?
Antwort
Die Formeln lauten H2O, CH4, CO2 bzw. NH3.
Auch wenn du dir die chemischen Formeln der in diesem Kurs vorgestellten Verbindungen nicht merken musst, wirst du es wahrscheinlich nützlich finden, dir einige davon einzuprägen, z. B. die für die vier oben genannten Moleküle sowie die für Wasserstoff- (H2), Stickstoff- (N2) und Sauerstoffmoleküle (O2). Das wird dir helfen, diese chemischen Formeln zu lesen und zu schreiben, ohne ständig auf frühere Abschnitte zurückgreifen zu müssen.
Nun wirst du Reaktionen betrachten, an denen die Elemente Wasserstoff, Kohlenstoff und Sauerstoff sowie die Verbindungen Methan, Wasser und Kohlendioxid beteiligt sind.
Wasserstoff reagiert mit Sauerstoff, wenn er entzündet wird (er ist ziemlich explosiv) und bildet Wasser. Um eine solche Reaktion in Form einer chemischen Gleichung zu schreiben, werden die Stoffe, die die Reaktion eingehen, auf der linken Seite und die Stoffe, die bei der Reaktion entstehen, auf der rechten Seite eingetragen. Die Reaktanten auf der linken Seite sind mit den Produkten auf der rechten Seite durch einen Pfeil verbunden.
Die Gleichung kann als Wortgleichung geschrieben werden: „Wasserstoff und Sauerstoff bilden Wasser“, oder mit ein wenig chemischer Kurzschrift:

wobei der Pfeil „geht zu“ bedeutet.
Nun versuche, die Gleichung mit chemischer Kurzschrift zu schreiben. Das Einsetzen der Symbole in die Wortgleichung ergibt:

Die Gleichung zeigt, dass die Reaktanten auf der linken Seite des Pfeils in das Produkt auf der rechten Seite umgewandelt werden. Allerdings stimmt etwas nicht mit dieser Gleichung. Sie können sehen, was falsch ist, wenn Sie sich Abbildung 21 ansehen, in der die Reaktanten und Produkte in einem Diagramm dargestellt sind.
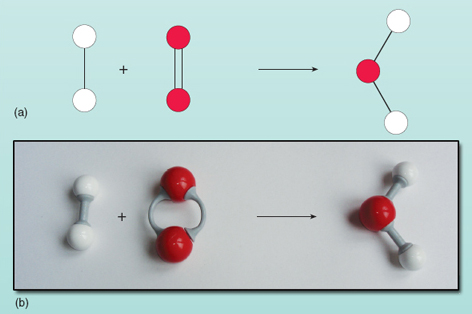
Zählt man die Anzahl der Atome auf jeder Seite der Gleichung, so stellt man fest, dass sich auf der linken Seite zwei Sauerstoffatome befinden, auf der rechten Seite dagegen nur ein Atom. Die Anzahl der Sauerstoffatome auf beiden Seiten der Gleichung muss gleich sein – sie können nicht auf magische Weise während einer Reaktion erscheinen und verschwinden. Es ist nicht möglich, die Zusammensetzung des Wassermoleküls auf der rechten Seite der Gleichung zu ändern, da das Wassermolekül aus zwei Wasserstoffatomen und einem Sauerstoffatom besteht, die miteinander verbunden sind. Jedes Sauerstoffmolekül liefert zwei Sauerstoffatome und bildet daher immer zwei Wassermoleküle, vorausgesetzt, es gibt zwei Wasserstoffmoleküle (die jeweils aus zwei Atomen bestehen), die mit ihm reagieren. Es werden also zwei Moleküle Wasserstoff und ein Molekül Sauerstoff benötigt, um zwei Moleküle Wasser zu bilden. Die Reaktion wird genau ausgedrückt durch:

Jetzt befinden sich auf beiden Seiten der Gleichung gleich viele Atome jeder Art: Die chemische Gleichung ist ausgeglichen, so dass wir den Pfeil durch ein Gleichheitszeichen ersetzen können.
Eine letzte Korrektur, um zu vermeiden, dass sich die Wasserstoffmoleküle auf der linken Seite der Gleichung und die Wassermoleküle auf der rechten Seite wiederholen, besteht darin, sie durch 2H2 statt H2 + H2 darzustellen. Die ausgeglichene chemische Gleichung lautet dann:

Dies ist in Abbildung 22 schematisch dargestellt.

Chemische Gleichungen zeigen nicht nur auf sehr prägnante Weise, welche Atome und Moleküle miteinander reagieren, um die Produkte zu bilden, sondern auch, wie viele von jeder Art von Atom und Molekül beteiligt sind. Es ist wichtig, sich daran zu erinnern, dass die Zahl vor einem Molekül die Zahl dieses bestimmten Moleküls bedeutet. Zum Beispiel bedeutet 3H2O drei Moleküle Wasser, was insgesamt sechs Wasserstoff- und drei Sauerstoffatome ergibt.
Chemische Gleichungen müssen ausgeglichen sein; die Anzahl der Atome jeder Art von Element auf beiden Seiten der Gleichung muss gleich sein.
Sie wissen jetzt, wie man eine chemische Gleichung „liest“ oder interpretiert – und wie sie einen chemischen Prozess darstellt. Chemiker sind aber auch sehr geschickt darin, chemische Gleichungen als eine Art Kurzschrift zu schreiben, um verschiedene chemische Prozesse oder Reaktionen zu beschreiben. Mit dem Schreiben chemischer Gleichungen ist es wie mit jeder Fremdsprache – man muss üben, um sie fließend zu beherrschen. Alle angehenden Wissenschaftler müssen jedoch irgendwo anfangen, und der folgende Abschnitt zeigt Ihnen, wie Sie dies anhand einer sehr bekannten chemischen Reaktion tun können. Wenn Sie prüfen möchten, ob Sie diesen Abschnitt lernen müssen, versuchen Sie es zuerst mit Frage 20.