Hast du dich schon einmal gefragt, warum Leuchtstäbe (siehe Abb. 1) leuchten, nachdem du sie geknickt hast? Oder warum diese Plastiksterne nachts noch leuchten, wenn die Lichter schon ausgeschaltet sind? Vielleicht haben Sie das nicht. Aber egal, ob du dir diese Fragen gestellt hast oder nicht, der folgende Text wird dir hoffentlich Antworten und Erklärungen zu den Phänomenen der leuchtenden Armbänder, der leuchtenden Quallen, des Schwarzlichts und vielen anderen geben.

Abbildung 1. Leuchtstäbe.
Lumineszenz
Im Allgemeinen wird das Leuchten, das bei all den oben genannten Phänomenen auftritt, Lumineszenz genannt. Lumineszenz ist die Energie, die von einem Stoff in Form von Licht abgegeben wird. Es können mehrere Arten von Lumineszenz unterschieden werden:
- Ein Beispiel ist die Chemilumineszenz. Bei manchen chemischen Reaktionen wird Energie in Form von Licht freigesetzt. Dies geschieht zum Beispiel beim Biegen eines Leuchtstabes. Es ist auch der Grund für das Leuchten von Tieren wie Quallen oder einigen Mikroorganismen. In diesem Fall spricht man von Biolumineszenz.
- Eine andere Art ist die Tribolumineszenz. Sie kann beobachtet werden, wenn ein selbstklebender Umschlag in völliger Dunkelheit geöffnet wird oder wenn Klebeband in einem dunklen Raum abgerollt wird. Dabei wird mechanische Energie in das System eingebracht, die als Aktivator für das Leuchten dient.
- Die wohl bekannteste Art der Lumineszenz ist die Photolumineszenz. Hier wird die Energie durch elektromagnetische Strahlung bereitgestellt, zum Beispiel durch Sonnenlicht oder eine ultraviolette Lampe, wie in manchen Diskotheken. Dies führt zu Phänomenen wie dem Dauerleuchten von Plastiksternen oder der extremen Helligkeit weißer Kleidung unter Schwarzlicht. Man kann zwischen Fluoreszenz und Phosphoreszenz unterscheiden, die weiter unten erklärt werden.
Was ist ein elektronisch angeregter Zustand?
Generell beruhen alle Arten von Lumineszenz auf sogenannten photophysikalischen Prozessen. Meist werden die Moleküle selbst als fluoreszierend bezeichnet. Dies ist bei Fluoreszenzfarbstoffen wie Fluorescein oder Curcumin der Fall. Um die photophysikalischen Prozesse zu erklären, muss man jedoch eine noch kleinere Ebene als die molekulare genauer betrachten.
Atome verschiedener Elemente haben eine unterschiedliche Anzahl von Elektronen, die auf mehrere Schalen und Orbitale verteilt sind. Elektronen sind eine Art von Elementarteilchen. Elektronische Übergänge sind für die Lumineszenz verantwortlich. Wenn das System Energie aufnimmt, werden die Elektronen angeregt und in einen Zustand höherer Energie angehoben. Vor der Anregung, im Grundzustand, befinden sich einige der Elektronen im sogenannten HOMO (Highest Occupied Molecular Orbital). Nachdem sie einen angeregten Zustand erreicht haben, befinden sie sich im LUMO (Lowest Unoccupied Molecular Orbital) (siehe Abb. 2). Wie das genau funktioniert, wird am konkreten Beispiel der Photolumineszenz erklärt.

Abbildung 2. Elektronische Anregung.
Die verschiedenen energetischen Zustände eines Atoms oder Moleküls werden als „Energieniveaus“ bezeichnet. Je nach Molekül und Atom können die Elektronen nur diskrete Energieniveaus einnehmen, da die Energie gequantelt ist, das heißt, Energie kann nur in bestimmten Mengen aufgenommen und abgegeben werden. Die Differenz zwischen zwei Niveaus kann mit Gleichung 1 berechnet werden (wobei E2 das höhere und E1 das niedrigere Energieniveau ist).
(1) ΔE = E2-E1
Photonen, Teilchen, aus denen elektromagnetische Strahlung oder Licht besteht, müssen einen bestimmten Energiewert haben, um Elektronen anregen zu können. Die Energie eines Photons lässt sich mit Gleichung 2 berechnen, wobei h die Planck-Konstante und ν die Frequenz des Lichts ist.
(2) Ephoton = hν
Die notwendige Anregungsenergie für die Elektronen ist gleich der Differenz zwischen den Energieniveaus. Nur Licht mit einer bestimmten Energie, also mit einer bestimmten Frequenz und Wellenlänge, ist in der Lage, Elektronen anzuregen. Durch Gleichsetzen der Gleichungen 1 und 2 und mit Hilfe von Gleichung 3 (wobei c für die Lichtgeschwindigkeit steht) lassen sich die notwendige Frequenz und Wellenlänge berechnen (siehe Gl. 4). In vielen Fällen wird UV-Strahlung zur Anregung verwendet.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Deaktivierung von elektronisch angeregten Zuständen
Solche elektronisch angeregten Zustände sind instabil. Die Elektronen fallen in ihre Grundzustände zurück. Dabei wird die Anregungsenergie wieder freigesetzt. Man unterscheidet zwischen strahlenden und nichtstrahlenden Zerfallsprozessen. Meistens erfolgt der Zerfall nicht-strahlend, zum Beispiel durch Schwingungsrelaxation, Quenching mit umgebenden Molekülen oder interne Konversion (IC) . Diese Prozesse werden später im Detail erklärt.
Gelegentlich kann ein strahlender Zerfall in Form von Fluoreszenz und Phosphoreszenz auftreten. Die Energie wird in Form von elektromagnetischer Strahlung oder Photonen abgestrahlt. Das emittierte Licht hat eine größere Wellenlänge und eine geringere Energie als das absorbierte Licht, da ein Teil der Energie bereits in einem nicht-strahlenden Zerfallsprozess freigesetzt wurde. Dies ist der Grund dafür, dass eine Emission im sichtbaren Spektrum durch Anregung mit nicht sichtbarer UV-Strahlung erreicht werden kann. Diese Verschiebung zu einer längeren Wellenlänge wird als Stokes-Verschiebung bezeichnet.
Vergleich: Fluoreszenz vs. Phosphoreszenz
Beide, Fluoreszenz und Phosphoreszenz, sind spontane Emissionen von elektromagnetischer Strahlung. Der Unterschied besteht darin, dass das Leuchten der Fluoreszenz unmittelbar nach dem Abschalten der anregenden Strahlungsquelle aufhört, während bei der Phosphoreszenz ein Nachleuchten mit einer Dauer von Sekundenbruchteilen bis hin zu Stunden auftreten kann.
Um die fotophysikalischen Vorgänge, die beiden Phänomenen zugrunde liegen, zu vergleichen, gibt es einige Fakten über Elektronen, die zum Verständnis hilfreich sind: Elektronen sind Teilchen, die einen sogenannten Spin und eine Spinquantenzahl haben. Diese kann zwei verschiedene Werte haben, nämlich entweder +1/2 oder -1/2 . Diese Zahl ist eine Eigenschaft, die wir uns eigentlich nicht vorstellen oder leicht beschreiben können. Sie wird oft mit einem Kreisel verglichen, der sich entweder im oder gegen den Uhrzeigersinn dreht. Diese Beschreibung ist jedoch weder mathematisch noch physikalisch ganz korrekt. Zwei Elektronen in einem einzigen Orbital eines Atoms haben einen antiparallelen Spin, der als (↓) bezeichnet wird.
Fluoreszenz
Im Jablonski-Diagramm für Fluoreszenz (siehe Abb. 3) ist der Singulett-Spin-Zustand S0 der Grundzustand der Elektronen, und S1 und S2 sind angeregte Singulett-Zustände (die Zustände werden in diesem Text nur als Beispiel verwendet und gelten nicht unbedingt für bestimmte Atome, Moleküle usw.). Innerhalb dieser Zustände gibt es mehrere Energieniveaus. Je höher das Niveau ist, desto mehr Energie besitzt ein Elektron, wenn es sich in diesem Niveau befindet. Im Falle von Singulett-Zuständen haben die Elektronen antiparallele Spins.

Abbildung 3. Jablonski-Diagramm für die Fluoreszenz.
Die Elektronen werden bei der Anregung durch elektromagnetische Strahlung z. B. vom Grundzustand S0 auf ein Energieniveau des zweiten angeregten Zustands S2 angehoben. Nach Beendigung der Anregung verbleiben die Elektronen nur für eine kurze Zeit (ca. 10-15 s) in diesem angeregten Zustand und fallen dann sofort wieder in den Grundzustand zurück. Dabei kann zunächst Energie durch Schwingungsrelaxation an die Umgebung abgegeben werden. Das bedeutet, dass durch die Bewegung des Atoms oder Moleküls thermische Energie freigesetzt wird, bis das niedrigste Niveau des zweiten angeregten Zustands erreicht ist.
Die größere Lücke zwischen dem zweiten und dem ersten angeregten Zustand wird durch interne Konversion überwunden. Das beschreibt einen elektronischen Übergang zwischen zwei Zuständen, wobei der Spin der Elektronen erhalten bleibt. Nun können die Elektronen durch weitere Schwingungsrelaxation weiter relaxieren, bis sie das niedrigste Energieniveau des S1-Zustandes erreichen.
Theoretisch könnten die Elektronen sogar noch weiter auf nicht-radiativem Weg relaxieren, bis sie schließlich wieder den Grundzustand erreichen. Es kann aber sein, dass die letzte Energiemenge zu groß ist, um an die Umgebung abgegeben zu werden, weil die umgebenden Moleküle nicht so viel Energie aufnehmen können. Dann kommt es zur Fluoreszenz, die zur Emission von Photonen mit einer bestimmten Wellenlänge führt. Die Emission dauert nur so lange, bis sich die Elektronen wieder im Grundzustand befinden. Da bei all diesen Übergängen der Elektronenspin gleich bleibt, bezeichnet man sie als spin-erlaubt.
Phosphoreszenz
Bei der Phosphoreszenz liegen die Dinge etwas anders (siehe Abb. 4). Es gibt wieder einen S0-Grundzustand und die beiden angeregten Zustände S1 und S2. Zusätzlich gibt es einen angeregten Triplett-Zustand T1, der energetisch zwischen dem S0- und dem S1-Zustand liegt. Die Elektronen haben im Grundzustand wieder antiparallele Spins.
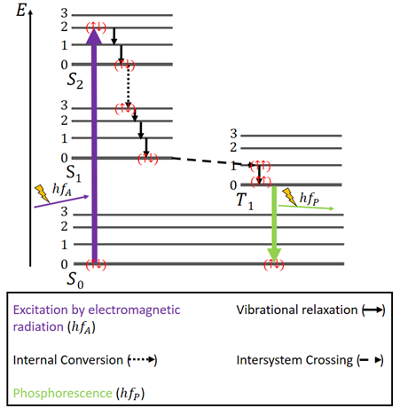
Abbildung 4. Jablonski-Diagramm für Phosphoreszenz.
Die Anregung erfolgt auf die gleiche Weise wie bei der Fluoreszenz, nämlich durch elektromagnetische Strahlung. Die Freisetzung von Energie durch Schwingungsrelaxation und interne Konversion bei gleichem Spin ist auch hier gleich, allerdings nur bis zum Erreichen des S1-Zustandes.
Neben den Singulett-Zuständen existiert ein Triplett-Zustand und es kann zum sogenannten Intersystem-Crossing (ISC) kommen, da der T1-Zustand energetisch günstiger ist als der S1-Zustand. Diese Kreuzung ist, wie die interne Umwandlung, ein elektronischer Übergang zwischen zwei angeregten Zuständen. Im Gegensatz zur internen Umwandlung ist ISC jedoch mit einer Spinumkehr vom Singulett zum Triplett verbunden. Die Elektronen im Triplett-Zustand haben parallele Spins, was als () bezeichnet wird. Dieser ISC-Prozess wird als „spin-forbidden“ bezeichnet. Er ist zwar nicht völlig unmöglich – aufgrund eines Phänomens, das als „Spin-Bahn-Kopplung“ bezeichnet wird -, aber doch eher unwahrscheinlich.
Im T1-Zustand ist auch ein nicht-radiativer Zerfall möglich. Ein Übergang zwischen dem niedrigsten Energieniveau des Triplett-Zustands und dem S0-Zustand ist jedoch nicht ohne weiteres möglich, da auch dieser Übergang spin-verboten ist. Dennoch kann er mit einer geringen Wahrscheinlichkeit stattfinden. Er verursacht eine eher schwache Emission von Photonen, da der Elektronenspin wieder umgekehrt werden muss. Die Energie ist in diesem Zustand eine Zeit lang gefangen und kann nur langsam freigesetzt werden. Nachdem alle Energie freigesetzt wurde, befinden sich die Elektronen wieder im Grundzustand.
Schlussfolgerung
Die spin-erlaubten und -verbotenen Prozesse dienen als Erklärung für das sofortige Aufhören des Fluoreszenzglühens und für das Nachleuchten der Phosphoreszenz. Phosphoreszenz tritt in der Regel nur bei „schwereren“ Molekülen auf, da der Spin mit Hilfe der Spin-Orbit-Kopplung umgekehrt werden muss. Ob überhaupt elektromagnetische Strahlung emittiert wird und mit welcher Wellenlänge, hängt davon ab, wie viel Energie zuvor durch nicht-strahlenden Zerfall freigesetzt werden kann. Es hängt auch von den Eigenschaften sogenannter Quencher ab, die Moleküle umgeben und größere Energiemengen aufnehmen können.
Alle Prozesse, die zu einer Hemmung von strahlenden Zerfällen führen können, können Fluoreszenzlöschung verursachen. Beispiele sind nicht-strahlende Zerfallsprozesse, aber auch die Zerstörung des fluoreszierenden Moleküls . Die Quanteneffizienz beschreibt die Effizienz des Prozesses und ist definiert als das Verhältnis von absorbierten und emittierten Photonen. Diese Eigenschaft ist für jede Substanz unterschiedlich.
Auch wenn sich dieser Text auf die Photolumineszenz konzentriert, sind die photophysikalischen Prozesse für alle Arten von Lumineszenz gleich.
Anwendungen
Neben Produkten wie Leuchtstäben werden Fluoreszenz und Phosphoreszenz auf viele andere Arten verwendet. Weitere Beispiele sind Wegweiser, die zu einem Notausgang führen und keinen Strom benötigen, sondern durch Phosphoreszenz nachts leuchten. Auch Pflanzen können fluoreszierend gemacht werden: Spinat kann mit Hilfe der Nanotechnologie so verändert werden, dass er Spuren von explosiven Stoffen im Grundwasser aufspüren kann. Die Blätter enthalten Kohlenstoff-Nanoröhrchen, an die sich Nitroaromaten binden können. Tun sie das, setzt die Pflanze ein fluoreszierendes Signal frei, das mit Infrarotkameras nachgewiesen werden kann.
Das Video demonstriert verschiedene Arten von Lumineszenz. Auf der linken Seite zeigt es die Fluoreszenz des Farbstoffs Curcumin, der im Gewürz Kurkuma enthalten ist, unter UV-Licht . Curcumin wird in Alkohol gelöst, um die Fluoreszenz sichtbar zu machen.
Die Plastikspinne und die Verbindung in der kleinen Röhre sind Beispiele für Phosphoreszenz. Das in der Röhre enthaltene Strontiumaluminat wird zunächst durch UV-Strahlung angeregt und strahlt schließlich grünes Licht aus. Die Ursache dafür ist eine Dotierung mit Elementen wie Europium, die die Verbindung als Leuchtpigment nutzbar macht.
Das Biegen des Leuchtstabs (rechts) löst eine chemische Reaktion zwischen Wasserstoffperoxid und einem Farbstoff und Phenyloxalat aus. Chemilumineszenz kann beobachtet werden.
Video 1. Fluoreszenz, Phosphoreszenz und Chemilumineszenz im Vergleich.
K. Arnold et al., Chemie Oberstufe, Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (in German), spektrum.de. (Zugriff am 25. Januar 2017)
D. Wiechoczek, Wenn Mineralien selbst leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (in German), chemieunterricht.de 2010. (Zugriff am 25. Januar 2017)
Lexikon der Physik: Photophysikalische Prozesse (in German), spektrum.de. (Zugriff am 27. Januar 2017)
D. Wiechoczek, Chemie mit Curry (in German), chemieunterricht.de 2015. (Zugriff am 27. Januar 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (in German), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (in German), chemie.de. (accessed January 27, 2017)
Bohr’sche Frequenzbeziehung (in German), chemgapedia.de. (accessed January 25, 2017)
Technische Universität Ilmenau, Praktikum Physikalische Chemie II: Physikalische Chemie/Mikroreaktionstechnik, Versuch Fluoreszenz-Quenching (in German), tu-ilmenau.de. (accessed January 27, 2017)
Stokesverschiebung (in German), chemie.de. (accessed January 25, 2017)
Elektronenspin (in German), chemie.de. (accessed January 27, 2017)
Quantenausbeute (in German), chemie.de. (accessed January 27, 2017)
Spinat erkennt Sprengstoff im Grundwasser (in German), Spiegel Online, November 1, 2016. (accessed January 27, 2017)
D. Weiß, Phosphoreszenz (in German), chemie.uni-jena.de. (Zugriff am 27. Januar 2017)
 Kim Dreier ist Schülerin am Marianne-Weber-Gymnasium in Lemgo.
Kim Dreier ist Schülerin am Marianne-Weber-Gymnasium in Lemgo.