Diese Struktur tritt auf, wenn zwei (oder mehr, z.B. ψ-Schleife) Segmente einer Polypeptidkette einander überlappen und eine Reihe von Wasserstoffbrückenbindungen miteinander bilden. Dies kann in paralleler Anordnung geschehen:

oder in antiparalleler Anordnung:
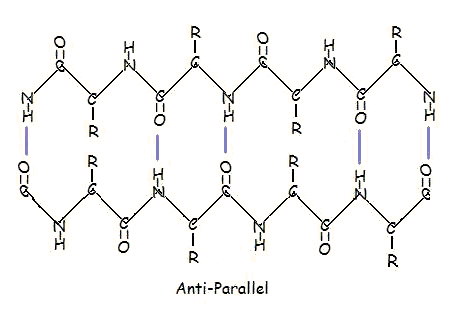
Parallele und antiparallele Anordnung ist die direkte Folge der Richtungsabhängigkeit der Polypeptidkette. Bei antiparalleler Anordnung befindet sich das C-terminale Ende eines Segments auf der gleichen Seite wie das N-terminale Ende des anderen Segments. Bei der parallelen Anordnung befinden sich das C-Terminus-Ende und das N-Terminus-Ende beider Segmente auf der gleichen Seite. Die „Faltung“ entsteht durch die abwechselnden Ebenen der Peptidbindungen zwischen den Aminosäuren; die ausgerichteten Amino- und Carbonylgruppen jedes gegenüberliegenden Segments wechseln ihre Ausrichtung von einander zugewandt in entgegengesetzte Richtungen.
Die parallele Anordnung ist weniger stabil, weil die Geometrie der einzelnen Aminosäuremoleküle die Wasserstoffbrückenbindungen dazu zwingt, in einem Winkel aufzutreten, wodurch sie länger und damit schwächer werden. Im Gegensatz dazu sind bei der antiparallelen Anordnung die Wasserstoffbrückenbindungen direkt gegenüberliegend ausgerichtet, was zu stärkeren und stabileren Bindungen führt.
Gemeinsam bildet sich ein antiparalleles Beta-Faltblatt, wenn eine Polypeptidkette ihre Richtung scharf umkehrt. Dies kann bei Vorhandensein von zwei aufeinanderfolgenden Prolinresten geschehen, die einen Knick in der Polypeptidkette erzeugen und sie auf sich selbst zurückbiegen. Für weit entfernte Segmente einer Polypeptidkette ist dies nicht notwendig, um Beta-Faltblätter zu bilden, aber für nahe gelegene Segmente ist es eine unabdingbare Voraussetzung. Bei kurzen Entfernungen sind die beiden Segmente eines beta-gefalteten Blattes durch 4+2n Aminosäurereste getrennt, wobei 4 die Mindestanzahl von Resten ist.