Einführung
Das menschliche Gehirn durchläuft während des gesamten Lebens einen umfassenden Reifungsprozess, um die kognitive Entwicklung zu fördern. Die Myelinisierung der Axone im gesamten Nervensystem ist ein solcher entscheidender Reifungsprozess. Im Zentralnervensystem (ZNS) strecken Gliazellen, die Oligodendrozyten genannt werden, viele Fortsätze in ihre Umgebung aus, die konzentrisch Membranen um die Axone wickeln und so Myelinscheiden bilden. Myelinscheiden ermöglichen die schnelle saltatorische Weiterleitung von Aktionspotenzialen, indem sie spannungsgesteuerte Na+-Kanäle in kurzen Lücken zwischen benachbarten Hüllen (den so genannten Ranvier-Knoten) lokalisieren und als elektrische Isolatoren wirken. Axone, die über ihre gesamte Länge vollständig myelinisiert sind, leiten Impulse um ein Vielfaches schneller als nicht myelinisierte Axone gleicher Querschnittsgröße (Waxman, 1980). Daher leiten myelinisierte neuronale Schaltkreise Informationen viel schneller als nicht myelinisierte Schaltkreise. Der Mensch wird mit einem praktisch nicht myelinisierten ZNS geboren, und die Oligodendrozytenpopulation wächst nach der Geburt dramatisch an, wobei es in den ersten Jahren der Kindheit zu einer weit verbreiteten Myelinisierung kommt. Die Myelinisierung setzt sich in der Jugend und im Erwachsenenalter in einer charakteristischen räumlich-zeitlichen Weise fort und korreliert mit der Entstehung und Aufrechterhaltung der richtigen Schaltkreisfunktion. Beispielsweise geht die Reifung der weißen Substanz (der myelinreichen Bereiche des ZNS) mit der Entwicklung kognitiver Prozesse in der Kindheit einher, wie etwa der Geschwindigkeit der Informationsverarbeitung (Mabbott et al., 2006; Scantlebury et al., 2014). Darüber hinaus werden Myelinpathologien/-abnormalitäten nicht nur bei der Entmarkungskrankheit Multiple Sklerose, sondern auch bei verschiedenen neurodegenerativen Erkrankungen (Kang et al., 2013; Huang et al., 2015) und neurologischen Entwicklungsstörungen (Takahashi et al., 2011) beobachtet. Die Myelinisierung einzelner Axone ist jedoch kein „Alles-oder-nichts“-Phänomen. Die Axone im ZNS weisen große Unterschiede in Bezug auf die Anzahl, Länge und Dicke der Myelinscheiden und deren Verteilung entlang ihrer Länge auf. Es gibt viele verschiedene Muster der Myelinisierung; so wurden beispielsweise Axone mit spärlich myelinisierten Regionen im jugendlichen und erwachsenen Mäusekortex beschrieben (Tomassy et al., 2014; Hill et al., 2018; Hughes et al., 2018). Die Veränderung eines dieser Hüllenparameter hat vorhersehbare Auswirkungen auf die Leitungsgeschwindigkeit des darunter liegenden Axons – daher kann die Festlegung eines spezifischen Musters der Myelinisierung entlang eines Axons besonders wichtig für die Feinabstimmung der Schaltkreisfunktion sein. So weisen beispielsweise Axone im auditorischen Hirnstamm von Wüstenrennmäusen entlang der distalen Regionen zunehmend kürzere Myelinscheiden auf, um das genaue Timing der Signalankunft zu gewährleisten und die Schalllokalisierung zu erleichtern (Ford et al., 2015). Subtile Veränderungen im Gesamtmuster der Myelinisierung entlang eines Axons (entweder durch die Hinzufügung neuen Myelins oder die Umgestaltung des vorhandenen Myelins) könnten das Timing neuronaler Impulse in Schaltkreisen tiefgreifend verändern. Wenn Myelin anpassungsfähig ist, dann könnte die Änderung solcher Myelinisierungsmuster einen wirksamen Mechanismus zur Regulierung der Schaltkreisfunktion während des gesamten Lebens darstellen.
Neue Erkenntnisse deuten darauf hin, dass Myelin als Reaktion auf die Schaltkreisaktivität anpassungsfähig sein könnte. Mit Hilfe der Ganzhirn-Diffusionstensor-Bildgebung können weitreichende Veränderungen in der myelinreichen weißen Substanz im Laufe der Zeit gemessen werden – solche Experimente an Menschen und Nagetieren haben gezeigt, dass das Erlernen einer neuen Aufgabe mit Veränderungen der weißen Substanz in relevanten Hirnregionen korreliert (Scholz et al., 2009; Sampaio-Baptista et al., 2013). Analysen auf zellulärer Ebene in Tiermodellen zeigen, dass die Produktion neuer myelinisierender Oligodendrozyten für effizientes motorisches Lernen erforderlich ist (McKenzie et al., 2014; Xiao et al., 2016). Derzeit wird angenommen, dass die Aktivität des neuronalen Schaltkreises Veränderungen des Myelins auslösen kann; umfangreiche Forschungsarbeiten haben gezeigt, dass neuronale Aktivität die Proliferation von Oligodendrozyten-Vorläuferzellen (OPCs), die Differenzierung von Oligodendrozyten sowie die Bildung und das Wachstum von Myelinscheiden beeinflussen kann. Diese Forschung, einschließlich der Beweise für die beteiligten molekularen Signale, wurde an anderer Stelle ausführlich besprochen (Fields, 2015; Almeida und Lyons, 2017; Mount und Monje, 2017). Neuronale Aktivität könnte Veränderungen des Myelins bewirken, die wiederum die Leitungsgeschwindigkeiten verändern könnten, um die der Funktion des Schaltkreises zugrunde liegenden Zeitabläufe fein abzustimmen.
Wir wissen jedoch immer noch nicht, ob oder wie die Myelinisierung von Schaltkreisen im Laufe des Lebens dynamisch reguliert wird. Untersuchungen an Nagetieren zeigen, dass neue Oligodendrozyten im gesamten ZNS auch im Erwachsenenalter gebildet werden (Young et al., 2013), und OPCs sind im menschlichen Gehirn vorhanden (Chang et al., 2000). Karbondatierungsanalysen von menschlichem Gewebe haben im Kortex Oligodendrozyten identifiziert, die im Erwachsenenalter entstanden sind, obwohl dieselben Analysen darauf hinwiesen, dass die Mehrheit der Oligodendrozyten im Corpus callosum aus der frühen Kindheit stammt (Yeung et al., 2014). Die Neuroimaging-Studien beim Menschen, die strukturelle Veränderungen der weißen Substanz mit dem Erlernen von Aufgaben korrelieren, legen jedoch nahe, dass neues Myelin während des gesamten Lebens gebildet werden kann. Eine solche langwierige Myelinisierung würde im Prinzip eine lebenslange Produktion von Oligodendrozyten erfordern, da einzelne myelinisierende Oligodendrozyten nur ein begrenztes Zeitfenster von wenigen Stunden haben, um die Bildung neuer Hüllen zu initiieren (Watkins et al., 2008; Czopka et al., 2013), und die Anzahl der Hüllen pro Oligodendrozyt scheint im Laufe der Zeit stabil zu sein (Tripathi et al., 2017). Eine Einschränkung, auf die Mount und Monje (2017) hinweisen, ist, dass das „Geburtsdatum“ im Kohlenstoffdatierungsexperiment (das den Zeitpunkt der DNA-Replikation während der Zellteilung identifiziert) das des OPC und nicht unbedingt das des differenzierten Oligodendrozyten widerspiegelt. Dies ist wichtig, da es Hinweise darauf gibt, dass sich OPCs direkt in Oligodendrozyten differenzieren können, ohne dass eine Zellteilung stattfindet, zumindest bei Nagetieren (Hughes et al., 2013). OPCs im Corpus callosum könnten sich viele Jahre nach ihrer terminalen Zellteilung direkt in Oligodendrozyten differenzieren; daher kann der Zeitpunkt der Differenzierung dieser neuen Oligodendrozyten nicht durch Kohlenstoffdatierung bestimmt werden, und daher haben Yeung et al. (2014) die Rate der Oligodendrozytenproduktion im erwachsenen menschlichen Gehirn möglicherweise unterschätzt. Wir müssen noch viel über die relativen Beiträge der Oligodendrozytenbildung und des Myelinumbaus zur ZNS-Entwicklung im Laufe des Lebens lernen.
Um die genaue Dynamik der Oligodendrogenese, der Myelinbildung und des Myelinumbaus in den verschiedenen Lebensstadien vollständig zu verstehen, ist die hochauflösende Längsschnitt-Bildgebung der beste Ansatz. Hier geben wir einen Überblick über aktuelle In-vivo-Bildgebungsstudien, die beginnen, die Dynamik der Myelinisierung zu klären, was es uns auch ermöglichen wird, zu verstehen, wie sich diese Dynamik auf die Funktion neuronaler Schaltkreise auswirken könnte.
De-novo-Myelinisierung
Um endgültig zu klären, wie Oligodendrozyten generiert werden und wie Myelin in vivo gebildet und dynamisch umgebaut wird, haben zwei aktuelle Studien die wiederholte Zwei-Photonen-Bildgebung des somatosensorischen Kortex der Maus über längere Zeiträume verwendet. Hughes et al. (2018) bildeten den Kortex von transgenen Reportermäusen mit fluoreszenzmarkierten Zellen der oligodendroglialen Linie vom frühen Erwachsenenalter bis zum mittleren und hohen Alter (etwa P720) ab. Sie stellten fest, dass sich die Oligodendrozytenpopulation weiter ausbreitet und dass sich die kortikale Oligodendrozytendichte zwischen dem jungen Erwachsenenalter und dem mittleren Alter fast verdoppelt (Abbildung 1A). Dies ging mit einer mehr als zweifachen Zunahme der Anzahl der kortikalen Myelinscheiden einher. Aber wie nimmt die Zahl der Oligodendrozyten zu? In der frühen postnatalen Entwicklung werden viele Oligodendrozyten gebildet, aber nur eine Teilmenge überlebt und bildet später die Myelinscheiden der Axone (Barres et al., 1992). Dies scheint im Erwachsenenalter ähnlich zu sein – indem sie einzelne kortikale OPCs im erwachsenen Kortex bis zu 50 Tage lang verfolgten, zeigten Hughes et al. (2018), dass die Mehrheit der neu differenzierten Oligodendrozyten dem Zelltod unterliegt und nur 22 % überleben und zur Myelinisierung beitragen (Abbildung 1B). Es bleibt unbekannt, welcher Anteil der neu differenzierten Oligodendrozyten nach einer OPC-Teilung im Vergleich zur direkten Differenzierung entsteht. Sobald die Oligodendrozyten jedoch zur Myelinisierung übergehen, bleiben sie stabil, und es gibt keine Anzeichen dafür, dass myelinisierende Oligodendrozyten während eines 50-tägigen Bildgebungszeitraums dem Zelltod unterliegen.
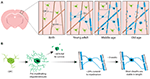
Abbildung 1. Oligodendrozyten- und Myelin-Dynamik im Kortex von Säugetieren während des gesamten Lebens. (A) Oligodendrozyten-Vorläuferzellen (OPCs) erzeugen im somatosensorischen Kortex von der Geburt bis zum mittleren Lebensalter kontinuierlich neue myelinisierende Oligodendrozyten (OLs). Die OL-Population nimmt dann im Alter ab, begleitet von einer Verringerung der Myelinbedeckung. (B) Das Lineage-Tracing einzelner OPCs zeigt, dass, obwohl im Erwachsenenalter kontinuierlich vormyelinisierende OLs produziert werden, nur etwa 20 % überleben und myelinisieren. Die meisten einmal gebildeten Myelinscheiden sind über einen längeren Zeitraum hinweg in ihrer Länge stabil, was darauf hindeutet, dass das vorhandene Myelin normalerweise nur in sehr geringem Maße umgebaut wird. Zusammenfassung der Daten von Hill et al. (2018) und Hughes et al. (2018).
Auch Hill et al. (2018) verwendeten transgene Reporter von Oligodendrozyten und die markierungsfreie spektrale konfokale Reflexionsmikroskopie (SCoRe), um Myelin entlang von Axonen (Schain et al., 2014) im somatosensorischen Kortex von jugendlichen, jungen erwachsenen, mittelalten und alten Mäusen (P950) abzubilden. Sie fanden auch heraus, dass die Anzahl der Oligodendrozyten im Erwachsenenalter bis zu P650 weiter zunimmt und dass die Oligodendrozyten im mittleren Alter bis zu 80 Tage nach der Aufnahme stabil sind. Sie fanden heraus, dass die Myelinisierung des Kortex ebenfalls im mittleren Alter bei P650 ihren Höhepunkt erreicht und dass die Oligodendrozytendichte von ihrem Höhepunkt (bei P650) bis ins hohe Alter (P950) deutlich abnimmt (Abbildung 1A). Dies spiegelt sich in einer Verringerung der Myelinbedeckung der kortikalen Axone der Schicht I zwischen P650 und P950 wider. Das langfristige Überleben von Oligodendrozyten kann zwischen verschiedenen Teilen des ZNS variieren. Tripathi et al. (2017) markierten myelinisierende Oligodendrozyten bei Mäusen im Alter von P60 und zählten dann, wie viele markierte Zellen bis P605 in verschiedenen ZNS-Regionen überlebten. Sie fanden heraus, dass im Rückenmark und im motorischen Kortex 60-70 % der P60-markierten Zellen überlebten, während im Corpus Callosum über 90 % der P60-markierten Zellen überlebten. Die Abnahme der Zahl der Oligodendrozyten und der Myelinisierung in bestimmten Regionen des ZNS mit zunehmendem Alter wirft interessante Fragen über die Rolle des Myelinverlusts beim altersbedingten kognitiven Abbau auf. MRT-Analysen zeigen, dass die Mikrostruktur der weißen Substanz mit der fluiden Intelligenz korreliert (Ritchie et al., 2015), aber auch, dass sich diese Mikrostruktur der weißen Substanz mit zunehmendem Alter verschlechtert (Cox et al., 2016). Ein nachfolgender altersbedingter Myelinverlust könnte zu einer verminderten kognitiven Funktion aufgrund einer Dysregulation der myelinisierten Schaltkreise führen.
Könnte die Bildung neuer Oligodendrozyten (und in der Folge neuen Myelins) im erwachsenen Kortex auf die Schaltkreisaktivität reagieren? Frühere Forschungen haben gezeigt, dass die Verringerung des sensorischen Inputs durch das Entfernen der Schnurrhaare bei Mäusen zu einer reduzierten Oligodendrogenese im somatosensorischen Kortex führt (Hill et al., 2014). Um dies weiter zu untersuchen, versorgten Hughes et al. (2018) erwachsene (P365) Mäuse drei Wochen lang mit sensorischen Reizen, indem sie Perlen in die Tierkäfige hängten, um ihre Schnurrhaare und damit den somatosensorischen Kortex wiederholt zu stimulieren. Durch Bildgebung der somatosensorischen Hirnrinde vor und nach den drei Wochen zeigten sie, dass die sensorische Stimulation die Anzahl der Oligodendrozyten erhöht, was möglicherweise auf das erhöhte Überleben neu differenzierter Zellen zurückzuführen ist. Kougioumtzidou et al. (2017) lieferten weitere Belege dafür, dass die Aktivität des Schaltkreises bei der Regulierung des Zellüberlebens eine wichtige Rolle spielen könnte – sie zeigten, dass der Verlust der AMPA-Rezeptor-Untereinheiten 2, 3 und 4 in OPCs zu einem geringeren Überleben von Oligodendrozyten führt. Dies deutet darauf hin, dass die de novo-Myelinisierung durch die Aktivität der kortikalen Schaltkreise während des gesamten Lebens moduliert werden könnte, vielleicht um die Funktion eben dieser Schaltkreise fein abzustimmen.
Viele Fragen sind noch zu klären: Wie wirken sich die Oligodendrogenese und die neue Myelinisierung auf die tatsächliche Funktion der Schaltkreise aus? Verbessert die neuronale Aktivität das langfristige Überleben der myelinisierenden Oligodendrozyten? Es ist möglich, dass der Verlust von Oligodendrozyten im Alter auf eine altersbedingte Verringerung der neuronalen Aktivität zurückzuführen ist, was sich wiederum auf das Gesamtüberleben der Oligodendrozyten auswirken könnte. Es könnte aber auch sein, dass Oligodendrozyten unabhängig von der neuronalen Aktivität eine begrenzte Lebensdauer haben (entweder intrinsisch programmiert oder durch andere extrinsische Signale beeinflusst, die mit dem Altern einhergehen). In jedem Fall könnte die Stimulation des Kreislaufs dazu beitragen, den altersbedingten Myelinverlust zu verringern, indem entweder das Überleben der vorhandenen Oligodendrozyten gefördert oder die Produktion neuer Oligodendrozyten angeregt wird. Dies wiederum könnte erhebliche Auswirkungen auf die Behandlung und Vorbeugung des altersbedingten kognitiven Verfalls haben.
Die aktivitätsvermittelte Oligodendrogenese ist nicht auf den somatosensorischen Kortex beschränkt – junge erwachsene Mäuse, die motorisches Lernen erfahren, zeigen auch einen Anstieg der Anzahl neu differenzierter Oligodendrozyten im motorischen Kortex (Xiao et al., 2016). Was ist mit anderen Bereichen des ZNS? Viele kortikale Axone projizieren über den Corpus Callosum, und daher könnte die Stimulation kortikaler Schaltkreise sowohl kortikale als auch kallosale OPCs ansprechen. Zwei Studien an Nagern haben gezeigt, dass die Stimulation kortikaler Neuronen die Oligodendrogenese im Corpus callosum auslöst. Gibson et al. (2014) stimulierten optogenetisch Projektionsneuronen der Schicht V im prämotorischen Kortex und stellten einen Anstieg der OPC-Proliferation sowohl im prämotorischen Kortex als auch im Corpus Callosum fest. Dies führte 4 Wochen nach der Stimulation zu einer Zunahme der Anzahl der Oligodendrozyten und der Dicke der Hüllen. Kürzlich verwendeten Mitew et al. (2018) Designer-Rezeptoren, die ausschließlich durch Designer-Medikamente aktiviert werden, um somatosensorische Neuronen der Schicht 2/3 zu stimulieren, und beobachteten ebenfalls eine erhöhte OPC-Proliferation, Oligodendrogenese und dickere Myelinscheiden im Corpus callosum sowohl bei jugendlichen als auch bei erwachsenen Mäusen. Sie zeigten auch, dass neue Oligodendrozyten bevorzugt Myelinscheiden auf den aktiven Axonen bilden. Dies deutet darauf hin, dass eine aktivitätsinduzierte de novo-Myelinisierung im Prinzip auf aktive Axone/Kreisläufe abzielen kann. Unbekannt bleibt, wie dauerhaft die Veränderungen des Myelins als Reaktion auf neuronale Aktivität sein könnten. Das von Tripathi et al. (2017), Hill et al. (2018) und Hughes et al. (2018) beobachtete langfristige Überleben von myelinisierenden Zellen deutet darauf hin, dass ein Oligodendrozyt, der einmal Myelinscheiden gebildet hat, wahrscheinlich auch dann überlebt, wenn die neuronale Aktivität wieder auf den Ausgangswert zurückgeht. Ob sich die Myelinscheiden selbst verändern, wenn die neuronale Aktivität auf ein normales Niveau zurückkehrt, erfordert eine genauere Untersuchung der individuellen Scheibendynamik, die weiter unten erörtert wird.
Es ist also möglich, dass in vielen Regionen des ZNS eine lebenslange de novo-Myelinisierung stattfindet, wenn die für die Myelinisierung geeigneten Axone genügend ungemyelinisierten Raum haben. Es bleibt jedoch unklar, in welchem Ausmaß die Oligodendrogenese in den verschiedenen Bereichen des erwachsenen menschlichen Gehirns fortgesetzt wird. Eine Kohlenstoffdatierungsanalyse legt nahe, dass die meisten Oligodendrozyten im Corpus-Callosum-Trakt in der frühen Kindheit gebildet werden (Yeung et al., 2014). Die immunhistochemische Analyse von menschlichem Hirngewebe unter Verwendung eines neuartigen Markers für neu differenzierte Oligodendrozyten (BCAS1) zeigt neue Oligodendrozyten in der frontalen Hirnrinde bis über das mittlere Lebensalter hinaus, aber sehr wenige neue Oligodendrozyten in der weißen Substanz nach dem dritten Lebensjahrzehnt (Fard et al., 2017). Dieser Unterschied in der Oligodendrogenese zwischen den Spezies könnte eine Folge der Größenordnung sein. Die Daten von Hughes et al. (2013) für Nagetiere deuten darauf hin, dass Oligodendrozyten in einem enormen Überschuss gebildet werden, wobei fast 80 % der Zellen kontinuierlich abgeschnitten werden. Ist dieser Mechanismus angesichts der Energiekosten eines solchen Prozesses in einem Organ von der Größe des menschlichen Gehirns lebenslang haltbar? Vielleicht gibt es im menschlichen Gehirn nur eine begrenzte Überproduktion von Oligodendrozyten, weil die Myelinisierung des größeren ZNS länger dauern muss oder weil Signale wie neuronale Aktivität die OPCs dazu anregen, sich bei Bedarf in Oligodendrozyten zu differenzieren.
Myelinumbau
Der Umbau bestehender Myelinscheiden könnte die Leitungseigenschaften verändern, ohne dass neue Oligodendrozyten oder Myelin erzeugt werden müssen. Eine Änderung der Länge bestehender Myelinscheiden könnte die Myelinbedeckung entlang eines Axons und den Abstand zwischen den Ranvier-Knoten verändern (was sich beides auf die Leitungsgeschwindigkeit auswirken würde). Darüber hinaus könnten selbst sehr subtile Myelinumgestaltungen die Länge der Knoten selbst verändern. Kürzlich wurde gezeigt, dass die Länge der Knoten im Sehnerv und in der Hirnrinde stark variieren kann, und dass eine Änderung der Knotenlängen entlang eines Axons im Prinzip auch die Leitungsgeschwindigkeit erheblich verändern kann (Arancibia-Cárcamo et al., 2017). Ob die Veränderungen der Ranvier-Knoten primär durch die Myelinisierung oder die Reorganisation des Axons selbst angetrieben werden, muss noch ermittelt werden.
Sowohl Hill et al. (2018) als auch Hughes et al. (2018) untersuchten in Längsschnittstudien einzelne Myelinscheiden im somatosensorischen Kortex der Maus über mehrere Wochen, um festzustellen, ob die Länge der Scheide dynamisch reguliert wird. Hill et al. (2018) fanden heraus, dass im frühen Erwachsenenalter (P90-120) zwar einige Hüllen eine Verlängerung oder Schrumpfung aufweisen, aber 81 % der beobachteten Hüllen stabil waren. Mit zunehmendem Alter können mehr Hüllen in ihrer Länge stabil werden; Hughes et al. (2018) verfolgten Hüllen bei älteren Tieren (P365) und stellten fest, dass 99 % der Hüllen über drei Wochen stabil blieben (Abbildung 1B).
Eine ähnliche Stabilität der Hüllenlänge wurde auch an anderer Stelle beschrieben; Auer et al. (2018) untersuchten mit larvalen Zebrafischen, ob sich einzelne Hüllen im Laufe der Zeit in ihrer Länge verändern können, indem sie Live-Bildgebung von fluoreszenzmarkierten Myelinhüllen im Zeitverlauf durchführten. Sie fanden heraus, dass einzelne Hüllen in den ersten Tagen nach ihrer Bildung ein schnelles, aber variables Wachstum erfahren, bevor sich ihre Hüllenlänge stabilisiert. Sobald sie sich stabilisiert haben, wachsen sie nur noch in dem Maße weiter, wie das Tier insgesamt wächst.
Warum verändern einige Hüllen im Kortex ihre Länge, während andere dies nicht tun? Dies könnte auf die unterschiedlichen Anforderungen der verschiedenen neuronalen Schaltkreise zurückzuführen sein. Axonale Vielfalt wurde während der anfänglichen Myelinisierung im Rückenmark des Zebrafisches beobachtet, wo einige Axone die Freisetzung synaptischer Vesikel nutzen, um die Anzahl und Länge der Myelinscheiden zu regulieren, während andere dies nicht tun (Koudelka et al., 2016). Dies wirft die faszinierende Hypothese auf, dass nur einige Axone in der Lage sind, Myelin über aktivitätsbezogene Signale zu regulieren. Hughes et al. (2018) fanden heraus, dass ihr sensorisches Stimulationsparadigma den Anteil der dynamischen Hüllen im somatosensorischen Kortex nicht erhöhte. Eine detailliertere Analyse der Diversität der Axon-Subtypen in Verbindung mit einer Längsschnittstudie zur Dynamik der Hüllenlänge könnte jedoch bestätigen, ob die Umgestaltung der Hüllenlänge für bestimmte Schaltkreise spezifisch ist.
Spiegelt die Stabilität der Hüllenlänge eine Unfähigkeit der Hüllen zur Umgestaltung wider? Experimente im Zebrafisch deuten darauf hin, dass eine Umgestaltung der Hüllenlänge ausgelöst werden kann, wenn das Myelinisierungsprofil eines Axons gestört ist. Auer et al. (2018) entfernten einzelne Oligodendrozyten und damit einzelne Hüllen entlang von Axonen. Sie fanden heraus, dass, wenn eine einzelne Myelinscheide auf einem vollständig myelinisierten Axon verloren geht, die benachbarten Scheiden ein schnelles Wachstum wieder einleiten können, um die nicht myelinisierte Lücke zu bedecken. In mehreren Fällen bildete sich eine neue Myelinscheide anstelle ihres Vorgängers und konnte sogar gegen die eindringenden Nachbarscheiden zurückdrängen, um das ursprüngliche Muster der Myelinisierung wiederherzustellen (Abbildung 2A). Daher wird manchmal ein bestimmtes Myelinisierungsmuster bevorzugt beibehalten, selbst nach einer Myelinunterbrechung. Dies könnte dazu dienen, die optimierten Leitungseigenschaften des darunter liegenden Axons aufrechtzuerhalten. Auer et al. (2018) beobachteten im larvalen Zebrafisch spärlich myelinisierte Axone, wie sie zuvor im Kortex von Nagetieren identifiziert wurden. Interessanterweise fanden sie heraus, dass sich nach der Ablation einzelner Hüllen auf solchen spärlich myelinisierten Axonen eine neue Hülle praktisch an der gleichen Stelle wie die ablatierte Hülle bildete, sogar entlang eines ansonsten nicht myelinisierten Abschnitts des Axons (Abbildung 2B). Somit scheinen die Myelinisierungsmuster entlang spärlich myelinisierter Axone auch im Zebrafisch stabil erhalten zu bleiben, wie Hill et al. (2018) bei Nagetieren vermuten. Die Funktion der spärlichen Myelinisierungsprofile bleibt unbekannt. Solche Muster könnten eine dynamischere Feinabstimmung der Funktion einzelner Axone im Laufe der Zeit ermöglichen, obwohl es auch möglich ist, dass solche nicht myelinisierten Lücken eine allmähliche Myelinisierung erleichtern, um konsistente Leitungszeiten innerhalb von Schaltkreisen aufrechtzuerhalten, wenn das Tier wächst und/oder sich die Axonlängen ändern.
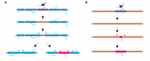
Abbildung 2. Myelinumbau kann in vivo stattfinden. (A) Die Ablation einzelner Hüllen auf einem vollständig myelinisierten Axon kann das schnelle Wachstum benachbarter Hüllen auslösen, um die Lücke zu schließen. Diese Lücke kann entweder vollständig von den benachbarten Hüllen bedeckt werden, oder das ursprüngliche Myelinisierungsprofil kann durch das Hinzufügen einer neuen Hülle wiederhergestellt werden. (B) Auf die Ablation einer Hülle an einem spärlich myelinisierten Axon folgt die Bildung einer neuen Myelinhülle von gleicher Größe und Lage wie die abgetragene Vorgängerhülle. Zusammenfassung der Daten von Auer et al. (2018).
Sind stabile Myelinscheiden bei Säugetieren auch in der Lage, sich umzubilden, wenn das Myelinisierungsmuster gestört ist? Um diese Frage zu beantworten, sind weitere Längsschnittstudien in Verbindung mit einer Demyelinisierung erforderlich. Es ist möglich, dass ein solcher Umbau nicht durch neuronale Aktivität ausgelöst wird, sondern ein Ausgleichsmechanismus für den Myelinverlust ist. Der altersbedingte Verlust von Oligodendrozyten könnte eine Umgestaltung der überlebenden Hüllen auslösen, um die abgestorbenen Teile des Axons zu bedecken und so zur Aufrechterhaltung der Schaltkreisfunktion beizutragen. Mit Hilfe der Live-Bildgebung von Myelinscheiden im Alter könnte festgestellt werden, ob dies der Fall ist.
Die hier besprochenen Live-Bildgebungsstudien haben alle die Dynamik der Myelinscheidenlänge, nicht aber die Myelinscheibendicke untersucht. Kann die Scheidendicke dynamisch reguliert werden? Die Stimulierung der PI3K/AKT/mTOR-Signalgebung in Oligodendrozyten erwachsener Mäuse löst eine zusätzliche Myelinumhüllung aus, die die Dicke der Myelinscheide erhöht (Snaidero et al., 2014). Dies kann durch die Aktivität des Schaltkreises moduliert werden, da die neuronale Stimulation sowohl bei jugendlichen als auch bei erwachsenen Mäusen zu einer erhöhten Scheidendicke führt (Gibson et al., 2014; Mitew et al., 2018). Dies unterstreicht die Notwendigkeit, alle Hüllenparameter im Längsschnitt abzubilden, um die Dynamik des Hüllenumbaus vollständig zu verstehen. Es besteht ein Bedarf an Live-Bildgebungsmodalitäten zur genauen Messung der Scheidendicke entlang der Axone, da dies derzeit eine Querschnittsmessung mittels Elektronenmikroskopie erfordert, die die Analyse auf einen einzigen Zeitpunkt beschränkt. Einige markierungsfreie Bildgebungsverfahren, wie die Mikroskopie der dritten harmonischen Generation und die Spektralreflektometrie, sind vielversprechend für die Durchführung solcher Messungen (Lim et al., 2014; Kwon et al., 2017). Durch die Kopplung dieser Techniken mit Längsschnittstudien am Kortex von Nagetieren könnte festgestellt werden, ob etablierte Myelinscheiden ihre Dicke anpassen können oder ob neuronale Aktivität einfach die De-novo-Myelinisierung vorantreibt, um dickere Hüllen zu erzeugen.
Es scheint also, dass Myelinscheiden zwar in der Lage sind, sich umzubilden, wenn das Myelin unterbrochen wird, die meisten Hüllen jedoch im Allgemeinen in ihrer Länge stabil sind. Diese Stabilität ist möglicherweise auf die Aufrechterhaltung früh etablierter Myelinisierungsmuster zurückzuführen, die für die Funktion der Schaltkreise optimiert sind.
Die Zukunft
Neuere bildgebende Studien an Säugetieren haben sich auf die De-novo-Myelinisierung und den Umbau der Hüllen in der grauen Substanz der Kortikalis konzentriert. Kortikale Schaltkreise empfangen und senden Informationen über viele Regionen, wie z. B. das Rückenmark und das Corpus callosum, und so könnten Veränderungen des Myelins in mehreren verschiedenen ZNS-Bereichen die Signalübertragung in einem einzigen Schaltkreis verändern. Das ZNS wird traditionell nach dem Aussehen nach der Formaldehyd-Fixierung beschrieben, wobei die „weiße Substanz“ die stark myelinisierten axonalen Bahnen beschreibt, während die „graue Substanz“ Regionen bezeichnet, die dicht mit neuronalen Zellkörpern, Dendriten und Synapsen besetzt sind. Diese Klassifizierung ist jedoch zu vereinfachend; OPCs produzieren myelinisierende Oligodendrozyten sowohl in der grauen als auch in der weißen Substanz (Dawson et al., 2003), und tatsächlich gibt es immer mehr Belege für die Vielfalt der oligodendroglialen Abstammung und der Myelinisierungsmuster in der grauen und weißen Substanz (Rivers et al., 2008; Viganò et al., 2013; Young et al., 2013; Bechler et al., 2015). Diese Vielfalt könnte die einzigartigen Anforderungen des Myelins in verschiedenen Bereichen und möglicherweise in verschiedenen Schaltkreisen des ZNS widerspiegeln. Weitere longitudinale Bildgebungsstudien sind erforderlich, um die Dynamik der De-novo-Myelinisierung und des Umbaus der Hüllen in Bereichen des ZNS jenseits des Kortex besser zu verstehen.
Während sich die optische Transparenz des larvalen Zebrafisches für nicht-invasive Live-Bildgebung anbietet, ist die Durchführung solcher Experimente im ZNS von Säugetieren invasiver und technisch anspruchsvoller. Hill et al. (2018) und Hughes et al. (2018) nutzten die Zwei-Photonen-Mikroskopie mit kranialen Bildgebungsfenstern, um Tiefen von bis zu 400 μm im Kortex abzubilden. Ähnliche Techniken könnten verwendet werden, um oberflächliche myelinisierte Bahnen im Rückenmark im Laufe der Zeit abzubilden (Locatelli et al., 2018), aber tiefere ZNS-Regionen können mit Zwei-Photonen-Mikroskopie allein nicht durchdrungen werden. Eine Alternative ist die Verwendung der Zwei-Photonen-Mikroendoskopie, bei der eine Mikroendoskop-Sonde mit einer Linse mit Gradientenbrechungsindex (GRIN) in das Gewebe eingeführt wird, um Zellen tiefer im Gehirn abzubilden. Das Einführen des Endoskops kann jedoch zu Entzündungsreaktionen führen, die die Myelinisierung beeinträchtigen könnten. Eine Alternative könnte die Drei-Photonen-Mikroskopie unter Verwendung der kranialen Bildgebungsfenstermethode sein, die auch schon zur Abbildung des Hippocampus verwendet wurde (Horton et al., 2013; Ouzounov et al., 2017). Die Drei-Photonen-Mikroskopie bietet ein deutlich besseres Signal-Hintergrund-Verhältnis als die Zwei-Photonen-Mikroskopie und kann daher zur Abbildung tieferer Gewebestrukturen verwendet werden.
Es ist besonders wichtig, nicht nur verschiedene ZNS-Regionen, sondern auch verschiedene Neuronen innerhalb dieser Regionen zu berücksichtigen. Frühere Forschungen legen nahe, dass es mechanistische Unterschiede darin gibt, wie verschiedene Neuronen-Subtypen ihre Myelinisierung regulieren (Koudelka et al., 2016). Darüber hinaus kann es Unterschiede in der lokalen Regulierung des Myelins geben. Es ist wichtig, daran zu denken, dass verschiedene Teile des ZNS keine separaten Einheiten sind, sondern miteinander verbunden sind. Die Integration der mesoskaligen Konnektomik, die sich auf das Verständnis der Verbindungen verschiedener Neuronen-Subtypen in verschiedenen Regionen konzentriert (Zeng, 2018), wird für unser Verständnis, wie die lebenslange Myelinisierungsdynamik zwischen verschiedenen Schaltkreisen variiert, von entscheidender Bedeutung sein.
Was ist die funktionelle Konsequenz der Myelinregulation entlang verschiedener Schaltkreise? Bislang lassen sich die funktionellen Auswirkungen nur aus Korrelationen mit dem Verhalten ableiten. Letztendlich muss die Messung der Myelin-Dynamik mit der direkten Bewertung der Aktivität der Schaltkreise gekoppelt werden. Dies erfordert die Aufzeichnung der neuronalen Aktivität während Längsschnittstudien zur Myelinisierung, um eine direkte Verbindung zwischen der de novo-Myelinisierung oder dem Umbau der Hüllen und den zeitlichen Veränderungen der Schaltkreisfunktionen herzustellen. Es wird wichtig sein, die Myelin-Dynamik und die elektrophysiologische Aktivität einzelner Neuronen und Axone zu messen, um festzustellen, wie sich Veränderungen der verschiedenen Myelinscheide-Parameter tatsächlich auf die Leitungseigenschaften auf der Ebene der einzelnen Zelle auswirken, und um die Aktivität auf Populationsebene zu bewerten. Instrumente wie genetisch kodierte Ca2+- oder Spannungsindikatoren ermöglichen eine relativ nicht-invasive Aufzeichnung der Schaltkreisaktivität und können sogar zur Bewertung der Aktivität des gesamten Gehirns verwendet werden (Ahrens et al., 2012; Lovett-Barron et al., 2017).
Schlussfolgerung
Die Myelinisierung von Axonen stellt einen leistungsstarken potenziellen Mechanismus zur Regulierung der Schaltkreisfunktion während des gesamten Lebens dar. Die Forschung hat gezeigt, dass eine De-novo-Myelinisierung im Kortex (über die Produktion neuer Oligodendrozyten) sogar im Erwachsenenalter stattfindet und dass diese durch die Stimulierung der Schaltkreisaktivität verstärkt werden kann. Wenn sich das Myelin einmal gebildet hat, ist es stabil, mit einem geringen Umsatz an Oligodendrozyten und einer begrenzten Umgestaltung der Länge der bestehenden Myelinscheiden. Diese stabilen Strukturen können jedoch die Fähigkeit behalten, sich umzubilden, wenn das Myelin gestört wird. Dies hat interessante Auswirkungen auf die Plastizität des Myelins bei der Aufrechterhaltung der Schaltkreisfunktion bei Verletzungen, Krankheiten und im Alter. Wie genau sich Veränderungen der Myelinisierung auf die Funktion des zugrunde liegenden Schaltkreises auswirken, bleibt abzuwarten. Letztlich ist ein Ansatz auf Schaltkreisebene erforderlich, der die Analyse der Myelin-Dynamik mit der direkten Messung der Schaltkreisfunktion verbindet, um vollständig zu verstehen, wie die dynamische Myelinisierung die Gesamtfunktion des Nervensystems während des gesamten Lebens beeinflusst.
Beiträge der Autoren
Alle aufgeführten Autoren haben einen wesentlichen, direkten und intellektuellen Beitrag zu dieser Arbeit geleistet und sie zur Veröffentlichung freigegeben.
Finanzierung
DAL wird durch ein Wellcome Trust Senior Research Fellowship (102836/Z/13/Z) unterstützt. JMW wird durch einen University of Edinburgh Ph.D. Tissue Repair Studentship Award (MRC Doctoral Training Partnership MR/K501293/1) und das Wellcome Trust Four-Year Ph.D. Program in Tissue Repair (Grant 108906/Z/15/Z) unterstützt.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Gehirnweite neuronale Dynamik während der motorischen Anpassung im Zebrafisch. Nature 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., and Lyons, D. A. (2017). On myelinated axon plasticity and neuronal circuit formation and function. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K., and Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). Beweise für den Umbau der Myelinscheide im ZNS durch In-vivo-Bildgebung. Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Zelltod und Kontrolle des Zellüberlebens in der Oligodendrozytenabfolge. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015). Die Länge der ZNS-Myelinscheide ist eine intrinsische Eigenschaft von Oligodendrozyten. Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., and Trapp, B. D. (2000). NG2-positive Oligodendrozyten-Vorläuferzellen im erwachsenen menschlichen Gehirn und in Läsionen der Multiplen Sklerose. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Alterung und Struktur der weißen Substanz des Gehirns bei 3.513 Teilnehmern der UK Biobank. Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., and Lyons, D. A. (2013). Einzelne Oligodendrozyten haben nur wenige Stunden Zeit, um in vivo neue Myelinscheiden zu bilden. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., and Reynolds, R. (2003). NG2-exprimierende gliale Vorläuferzellen: eine reichlich vorhandene und weit verbreitete Population von zyklischen Zellen im adulten ZNS der Ratte. Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). BCAS1-Expression definiert eine Population von frühen myelinisierenden Oligodendrozyten in Multiple-Sklerose-Läsionen. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Ein neuer Mechanismus der Plastizität des Nervensystems: Aktivitätsabhängige Myelinisierung. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Abstimmung der Eigenschaften des Ranvier-Knotens und der Internodien in myelinisierten Axonen zur Anpassung des Aktionspotential-Timings. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). Neuronale Aktivität fördert die Oligodendrogenese und adaptive Myelinisierung im Gehirn von Säugetieren. Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., and Grutzendler, J. (2018). Lebenslange kortikale Myelinplastizität und altersbedingte Degeneration im lebenden Säugetiergehirn. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., and Nishiyama, A. (2014). Modulation der Oligodendrozytenbildung während eines kritischen Zeitfensters nach der NG2-Zellteilung. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. (2013). In-vivo-Drei-Photonen-Mikroskopie von subkortikalen Strukturen in einem intakten Maushirn. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). Mutiertes Huntingtin regelt die durch den Myelin-Regulationsfaktor vermittelte Myelin-Genexpression herunter und beeinflusst reife Oligodendrozyten. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M., and Bergles, D. E. (2013). Oligodendrozytenvorläufer balancieren Wachstum und Selbstabstoßung aus, um eine Homöostase im erwachsenen Gehirn zu erreichen. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., and Bergles, D. E. (2018). Myelinumbau durch erfahrungsabhängige Oligodendrogenese im erwachsenen somatosensorischen Kortex. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., and Schnitzer, M. J. (2004). In-vivo-Bildgebung des Säugetiergehirns mit Ein- und Zweiphotonen-Fluoreszenz-Mikroendoskopie. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). Degeneration und gestörte Regeneration von Oligodendrozyten der grauen Substanz bei amyotropher Lateralsklerose. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Einzelne neuronale Subtypen weisen eine Vielfalt in der ZNS-Myelinisierung auf, die durch synaptische Vesikelfreisetzung vermittelt wird. Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). Signaling through AMPA receptors on oligodendrocyte precursors promotes myelination by enhancing oligodendrocyte survival. eLife 6:e28080. doi: 10.7554/eLife.28080
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Label-free nanoscale optical metrology on myelinated axons in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., and Webb, W. W. (2004). In-vivo-Multiphotonenmikroskopie von tiefem Hirngewebe. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., and Melendez-Vasquez, C. V. (2014). Markierungsfreie Darstellung der Myelinisierung von Schwann-Zellen durch Mikroskopie der dritten harmonischen Generation. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Mononukleäre Phagozyten spezifizieren und passen ihren Phänotyp in einem Multiple-Sklerose-Modell lokal an. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Ancestral circuits for the coordinated modulation of brain state. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., and Rockel, C. (2006). Das Wachstum der weißen Substanz als Mechanismus der kognitiven Entwicklung bei Kindern. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). Das Erlernen motorischer Fähigkeiten erfordert eine aktive zentrale Myelinisierung. Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). Pharmakogenetische Stimulation der neuronalen Aktivität erhöht die Myelinisierung auf axonspezifische Weise. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., and Monje, M. (2017). Wrapped to adapt: experience-dependent myelination. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). In-vivo-Drei-Photonen-Bildgebung der Aktivität von GCaMP6-markierten Neuronen tief im intakten Mäusegehirn. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Gekoppelte Veränderungen in der Mikrostruktur der weißen Substanz des Gehirns und fluide Intelligenz im späteren Leben. J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). PDGFRA/NG2-Glia erzeugt myelinisierende Oligodendrozyten und piriforme Projektionsneuronen in erwachsenen Mäusen. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). Das Erlernen motorischer Fähigkeiten führt zu Veränderungen in der Mikrostruktur der weißen Substanz und der Myelinisierung. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). Beziehungen zwischen der Reifung der weißen Substanz und der Reaktionszeit in der Kindheit. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., and Grutzendler, J. (2014). Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., and Johansen-berg, H. (2009). Training führt zu Veränderungen in der Architektur der weißen Substanz. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). Myelinmembranumhüllung von ZNS-Axonen durch PI(3,4,5)P3-abhängiges polarisiertes Wachstum an der inneren Zunge. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., and Buxbaum, J. D. (2011). Verknüpfung von Oligodendrozyten- und Myelin-Dysfunktion mit Anomalien der Neurozirkulation bei Schizophrenie. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. (2014). Distinct profiles of myelin distribution along single axons of pyramidal neurons in the neocortex. Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., and Richardson, W. D. (2017). Bemerkenswerte Stabilität von myelinisierenden Oligodendrozyten in Mäusen. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., and Dimou, L. (2013). Transplantation zeigt regionale Unterschiede in der Oligodendrozytendifferenzierung im erwachsenen Gehirn. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., and Barres, B. A. (2008). Unterschiedliche Stadien der Myelinisierung, reguliert durch Gamma-Sekretase und Astrozyten in einem schnell myelinisierenden ZNS-Kultursystem. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Determinants of conduction velocity in myelinated nerve fibers. Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). Eine schnelle Produktion neuer Oligodendrozyten ist in den frühesten Stadien des motorischen Lernens erforderlich. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Die Dynamik der Oligodendrozytenbildung und Myelinisierung im menschlichen Gehirn. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Oligodendrozytendynamik im gesunden erwachsenen ZNS: Hinweise auf Myelinumbau. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Mesoscale connectomics. Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar