Aspartat-Aminotransferasevon Luke Spooner
Inhalt
- 1 Funktion
- 2 Struktur
- 3 Funktion
- 4 Klinische Anwendungen
- 5 3D-Strukturen der Aspartat-Aminotransferase
Funktion
Aspartat-Aminotransferase (AAT), auch bekannt als Glutamat-Aspartat-Transaminase, Glutamat-Oxalessig-Transaminase, Präphenat-Aminotransferase und Transaminase A ist ein Enzym, das zur Klasse-I-Pyridoxalphosphat-abhängigen Aminotransferase-Familie gehört. Es wird durch das Gen GOT1 kodiert. Es handelt sich um ein Homodimer mit einer Länge von 413 Aminosäuren, das eine entscheidende Rolle im Aminosäure- und Kohlenhydratstoffwechsel, in der Ureogenese und beim Transfer von Reduktionsäquivalenten in die Mitochondrien und Chloroplasten spielt. In Prokaryontenzellen ist es ausschließlich im Cytosol zu finden, während es in eukaryontischen Zellen Cytosol-, Mitochondrien- und Chloroplasten-Isoenzyme gibt. Die bifunktionelle Aspartat-Aminotransferase (BAAT) ist für die Transaminierung von Prephanat in Arenat erforderlich.
Im menschlichen Körper wird es im Gehirn, in der Skelettmuskulatur, der Leber, der Bauchspeicheldrüse, den roten Blutkörperchen und den Nieren gebildet. Die breite Palette von Geweben, in denen es gebildet wird, unterscheidet es von dem ähnlichen Enzym Alanin-Transaminase (ALT), das hauptsächlich in der Leber vorkommt. Der AAT-Spiegel im Körper kann als Marker für Gewebekrankheiten oder -schäden verwendet werden. Außerdem können AAT- und ALT-Spiegel verglichen werden, um festzustellen, ob Gewebeschäden hauptsächlich in der Leber auftreten.
Struktur
, die (Alpha-Helices, Beta-Stränge, Schleifen, Drehungen) enthält. Asymmetrische Einheit der Aspartat-Aminotransferase, mit hervorgehobener kleiner und großer Domäne und PLP-Cofaktor (1b4x). Jede Untereinheit enthält eine gleichwertige aktive Stelle. Die Untereinheiten sind an zwei Stellen miteinander verbunden: zwischen ihren großen Domänen und zwischen den N-terminalen Resten und der großen Domäne der anderen Untereinheit. Diese Struktur von AST variiert von Organismen wie E. coli bis hin zum Menschen nur geringfügig. Außerdem ist die Struktur der aktiven Stelle mit einer Sequenzhomologie von 25 % hoch konserviert.
Jede Untereinheit des Homodimers ist außerdem in eine kleine und eine große Domäne unterteilt. Die kleine Domäne besteht aus den Aminosäuren vom N-Terminus bis zum Pro-48-Rest und vom Met-326-Rest bis zum C-Terminus. Die verbleibenden Aminosäuren bilden das , und die sind durch eine lange α-Helix verbunden, die aus 32 Aminosäuren besteht.
Die große Domäne ist der Ort, an dem sich das aktive Zentrum von AAT befindet, und um dies zu ermöglichen, enthält der Kern viele α/β-Supersekundärstrukturen. Im Gegensatz dazu ist der Kern der kleinen Untereinheit aus zwei α-Helices und zwei β-Strängen aufgebaut. In mehrzelligen Organismen gibt es am 325. Rest einen Knick, der als Scharnier für die kleine Domäne fungiert und die daraus resultierenden Konformationsänderungen ermöglicht, die bei der Bindung von Inhibitoren an das Enzym auftreten.
Wie bereits erwähnt, befindet sich das aktive Zentrum von AST in der großen Domäne der Untereinheit. Innerhalb des aktiven Zentrums befindet sich der Aminorest Lys 258, der auch als internes Aldimin bekannt ist und sich mit dem Cofaktor Pyridoxal-5′-phosphat () zu einer so genannten Schiffschen Base verbindet. Bei Zugabe eines Aminosäuresubstrats bildet sich eine neue Schiiff-Base zwischen PLP und der Aminosäure.
Funktion
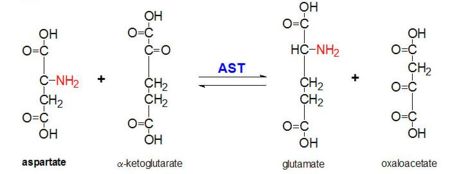
Abbildung 2: Transaminationsreaktion von L-Aspartat und α-Ketoglutarat, katalysiert durch Aspartat-Aminotransferase
AAT katalysiert die reversible Transaminierung der α-Aminogruppe von L-Aspartat zu α-Ketoglutarat unter Bildung von Oxalacetat und Glutamat. Diese Reaktivität ist in E. coli geringer als in höheren Eukaryonten und hat eine breitere Substratspezifität. Die Reaktion läuft jedoch auf die gleiche Weise ab. Wird ein Aminosäuresubstrat zugeführt, bildet sich eine neue Schiffsche Base zwischen ihr und dem PLP-Cofaktor. Dadurch verliert die Aminosäure einen Wasserstoff und bildet ein chinoides Zwischenprodukt, und es findet eine Reprotanisierung statt, bei der ein Ketimin entsteht. Anschließend wird die Struktur hydrolysiert, wobei eine α-Ketosäure und Pyridoxaminphosphat entstehen. 2-Methylaspartat wirkt als AAT-Inhibitor, wenn es mit dem PLP-Cofaktor eine Schiif-Base bildet, und nicht Aspartat. Dies führt dazu, dass der Prozess auf der Stufe vor der Eliminierung des Alpha-Proteins gestoppt wird.
Diese Reaktion ist für die Aufrechterhaltung der Homöostase in Organismen unerlässlich. Die vier verschiedenen Moleküle, die bei dieser Transanimation entstehen können (Oxalacetat, α-Ketoglutarat, Aspartat, L-Glutamat), sind für eine Reihe von Stoffwechselprozessen entscheidend. Oxalacetat und α-Ketoglutarat spielen eine entscheidende Rolle im Krebszyklus, verschiedene Formen von Aspartat sind wichtige Moleküle im Harnstoffzyklus und nehmen an der Gluconeogenese teil, und Glutamat ist ein wichtiges Molekül in Stoffwechselwegen, die mit dem Gedächtnis in Verbindung stehen.
Klinische Anwendungen
Der AAT-Spiegel im Körper ist ein Indikator für Gewebeschäden und Krankheiten. Normalerweise befindet sich AAT nur in minimalen Mengen im Blut, doch wenn die oben genannten Organe geschädigt sind, wird AAT ins Blut freigesetzt. Die freigesetzte Menge ist proportional zum Ausmaß der Schädigung. Es hat sich gezeigt, dass der AAT-Spiegel innerhalb von 6 Stunden nach der ersten Gewebeschädigung erheblich ansteigt und bis zu 4 Tage lang erhöht bleiben kann. Anhand der AAT-Werte im Vergleich zu den Werten anderer Enzyme können Ärzte feststellen, wo im Körper die Schädigung stattgefunden hat. Vergleiche mit ALT haben sich als besonders nützlich erwiesen, um Leberschäden wie Zirrhose und Hepatitis festzustellen. Unter normalen Bedingungen liegt der AAT-Spiegel bei Männern bei 6-34 IU/L und bei Frauen bei 8-40 IU/L.
3D-Strukturen der Aspartat-Aminotransferase
Aspartat-Aminotransferase 3D-Strukturen