Allgemeine Eigenschaften von Salzen
Einige der charakteristischen Eigenschaften von Salzen sind:
- Schmelz- und Siedepunkte: Salze sind meist Feststoffe, die bei hohen Temperaturen sowohl schmelzen als auch sieden.
- Löslichkeit in Wasser: Salze sind im Allgemeinen in Wasser löslich. Zum Beispiel sind Natriumchlorid, Kaliumsulfat, Aluminiumnitrat, Ammoniumcarbonat usw. lösliche Salze, während Silberchlorid, Bleichlorid, Kupfercarbonat usw. in Wasser unlöslich sind.
- Kristallwasser: Im Allgemeinen liegen Salze in Form von Kristallen vor, in denen Wassermoleküle enthalten sind. Dieses Wasser wird als Kristallwasser bezeichnet, und solche Salze werden als hydratisierte Salze bezeichnet.
Ein Kupfersulfatkristall hat beispielsweise fünf Wassermoleküle für jedes Kupfersulfatmolekül. Dies wird als CuSO4.5H2O geschrieben. Dieses Kristallwasser gibt dem Kristall seine Form. Außerdem verleiht es einigen Kristallen ihre Farbe. Beim Erhitzen verlieren hydratisierte Salze ihr Kristallwasser, wodurch die Kristalle ihre Form und Farbe verlieren und zu einer pulverförmigen Substanz werden.
Die hydratisierten Salze, die ihr Kristallwasser verloren haben, werden wasserfreie Salze genannt.
Wenn hydratisiertes Kupfersulfat erhitzt wird, gibt es Wassermoleküle ab und bildet weißes, pulverförmiges, wasserfreies Kupfersulfat. Bei Zugabe von Wasser kann sich diese Substanz wieder in eine Kupfersulfathydratlösung zurückverwandeln.
Menschen fragen auch
- Klassifizierung von Salzen
- Verwendung verschiedener Salze im täglichen Leben
- Zubereitung von Salzen
- Beschreiben Sie die Herstellung von löslichen und unlöslichen Salzen
- Qualitative Analyse von Salzen
- Wärmeeinwirkung auf Salze
- Untersuchung von Kationen und Anionen in wässrigen Lösungen
- Konstruieren von Ionengleichungen mit der Methode der kontinuierlichen Variation
- Was ist Stöchiometrie und warum wird sie in der Chemie verwendet?
Allgemeine Eigenschaften von Salzen:
1. Reaktion mit einer Säure : Wenn ein Salz mit einer Säure reagiert, entstehen ein anderes Salz und eine Säure. Wenn zum Beispiel Natriumchlorid mit Schwefelsäure erhitzt wird, entsteht Natriumhydrogensulfat (bei niedriger Temperatur) und dann Natriumsulfat (bei hoher Temperatur), und es wird Chlorwasserstoffgas entwickelt.
2. Reaktion mit einer Base : Ein Salz reagiert mit einer Base und bildet ein anderes Salz und eine andere Base.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reaktion mit einem Metall : Manchmal kann eine Salzlösung mit einem Metall reagieren. Taucht man zum Beispiel einen Eisennagel in eine wässrige Kupfersulfatlösung, so schlägt sich das Kupfer auf der Oberfläche des Nagels nieder, während das gebildete Eisensulfat in der Lösung verbleibt.
CuSO4 + Fe → FeSO4 + Cu
Diese Reaktion zeigt, dass Eisen reaktiver ist als Kupfer.
Das reaktionsfreudigere Metall kann also ein weniger reaktionsfreudiges Metall aus einer Lösung seines Salzes verdrängen.
4. Verhalten von Salzen gegenüber Wasser:
Wenn ein Salz in Wasser gelöst wird, kann die Lösung neutral, sauer oder alkalisch sein. Dies hängt von der Art des verwendeten Salzes ab.
(i) Ein normales Salz, das aus einer starken Säure und einer starken Base gewonnen wird, ergibt eine neutrale Lösung. Zum Beispiel sind die wässrigen Lösungen von NaCl und K2SO4 neutral gegenüber Lackmus.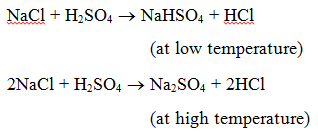
(ii) Ein normales Salz aus einer schwachen Säure und einer starken Base ergibt eine alkalische Lösung. Zum Beispiel sind die wässrigen Lösungen von Natriumcarbonat (Na2CO3) und Natriumacetat (CH3COONa) alkalisch.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Ein Salz, das sich von einer starken Säure und einer schwachen Base ableitet, ergibt eine saure Lösung. Zum Beispiel bilden sowohl Aluminiumchlorid (AlCl3) als auch Ammoniumchlorid (NH4Cl) saure wässrige Lösungen.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Lösungen von sauren Salzen sind sauer nach Lackmus, d.h. diese Lösungen färben blaues Lackmuspapier rot. Zum Beispiel färbt eine Lösung von Natriumhydrogensulfat (NaHSO4) blaues Lackmuspapier rot.
Natriumhydrogencarbonat (NaHCO3)-Lösung hingegen ist leicht alkalisch.