Darstellung chemischer Reaktionen
In diesem Kapitel werden wir einige Reaktionen kennenlernen, bei denen die wichtigsten Schritte die Bewegung einzelner Elektronen sind. Vielleicht erinnern Sie sich noch aus Abschnitt 6.1A, dass die Bewegung von Einzelelektronen durch einen Pfeil mit einem „Angelhaken“ dargestellt wird (im Gegensatz zu den bekannten Doppelpfeilen, die wir im ganzen Buch zur Darstellung der Bewegung von zwei Elektronen verwendet haben).

Einzelelektronen-Mechanismen beinhalten die Bildung und anschließende Reaktion von freien Radikalen, sehr instabilen Zwischenprodukten, die ein ungepaartes Elektron enthalten. Wir werden in diesem Kapitel lernen, wie freie Radikale oft durch homolytische Spaltung gebildet werden, ein Ereignis, bei dem sich die beiden Elektronen in einer brechenden kovalenten Bindung in entgegengesetzte Richtungen bewegen.

(Im Gegensatz dazu handelt es sich bei fast allen Reaktionen, die wir bisher untersucht haben, um bindungsbrechende Ereignisse, bei denen sich beide Elektronen in die gleiche Richtung bewegen: dies wird heterolytische Spaltung genannt).
Wir werden auch lernen, dass viele Ein-Elektronen-Mechanismen die Form einer radikalischen Kettenreaktion annehmen, bei der ein Radikal die Bildung eines zweiten Radikals verursacht, das wiederum die Bildung eines dritten Radikals verursacht, und so weiter.
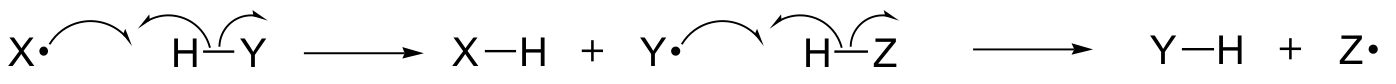
Die hohe Reaktivität freier radikalischer Spezies und ihre Fähigkeit, Kettenreaktionen auszulösen, ist oft von Vorteil – wir werden in diesem Kapitel über radikalische Polymerisationsreaktionen lernen, die nützliche Materialien wie Plexiglas und Polyproylengewebe bilden. Wir werden auch etwas über radikalische Reaktionen erfahren, die schädlich sind, wie z. B. der Abbau von Ozon in der Atmosphäre durch Freon und die oxidative Schädigung von Lipiden und DNA in unserem Körper durch freie Radikale. Schließlich werden wir sehen, wie einige Enzyme gebundene Metalle verwenden, um hohe e
Die Geometrie und relative Stabilität von Kohlenstoffradikalen
Als organische Chemiker sind wir besonders an radikalischen Zwischenstufen interessiert, bei denen sich das ungepaarte Elektron an einem Kohlenstoffatom befindet. Experimentelle Beweise deuten darauf hin, dass die drei Bindungen in einem Kohlenstoffradikal eine trigonal-planare Geometrie haben, und daher wird der Kohlenstoff als sp2-hybridisiert betrachtet, wobei das ungepaarte Elektron das senkrechte, unhybridisierte 2pz-Orbital besetzt. Vergleichen Sie dieses Bild mit den Zwischenstufen Carbokation und Carbanion, die beide ebenfalls trigonal planar sind, deren 2pz-Orbitale jedoch null bzw. zwei Elektronen enthalten.

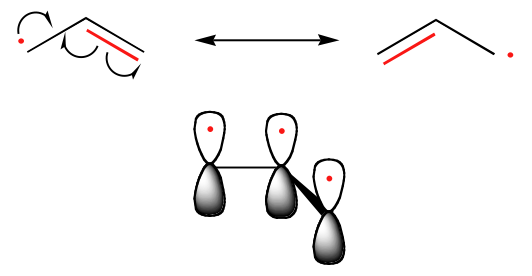
Der Trend in der Stabilität von Kohlenstoffradikalen verläuft parallel zu dem von Carbokationen (Abschnitt 8.4B): tertiäre Radikale sind beispielsweise stabiler als sekundäre Radikale, gefolgt von primären und Methylradikalen. Dies sollte intuitiv verständlich sein, da Radikale wie Carbokationen als elektronenarm angesehen werden können und daher durch die elektronenabgebende Wirkung benachbarter Alkylgruppen stabilisiert werden. Benzyl- und Allylradikale sind aufgrund von Resonanzeffekten stabiler als Alkylradikale – ein ungepaartes Elektron kann über ein System konjugierter pi-Bindungen delokalisiert werden. Ein Allylradikal kann zum Beispiel als ein System von drei parallelen 2pz-Orbitalen dargestellt werden, die sich drei Elektronen teilen.
Trends in der Stabilität von Radikalen
Allylisch & Benzyl > 3o > 2o > 1o > Methyl

In diesem Molekül wird die bereits umfangreiche Resonanzstabilisierung durch die Fähigkeit der Chloratome, das Radikalzentrum vor externen Reagenzien abzuschirmen, noch verstärkt. Das Radikal befindet sich gewissermaßen in einem schützenden „Käfig“.
Organische Chemie mit biologischem Schwerpunkt von Tim Soderberg (University of Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (University of Illinois Springfield)