Det foregående afsnit viser, hvordan forskellige grundstoffer enten kan eksistere alene eller kombineres med andre grundstoffer for at danne forbindelser. Dette afsnit bygger videre på disse idéer ved at se mere detaljeret på kemiske reaktioner. Det viser også, hvordan kemisk stenografi kan udvides til at beskrive kemiske reaktioner.
Først skal vi se på nogle af de molekyler, der er beskrevet tidligere: vand, metan, kuldioxid og ammoniak.
Spørgsmål 26
Hvad er formlerne for hvert af disse fire molekyler?
Svar
Formlerne er henholdsvis H2O, CH4, CO2 og NH3.
Og selv om du ikke behøver at huske de kemiske formler for forbindelser, der er introduceret i dette kursus, vil du sandsynligvis finde det nyttigt at huske nogle få som f.eks. formlerne for de fire molekyler ovenfor samt formlerne for hydrogen- (H2), nitrogen- (N2) og oxygen- (O2) molekyler. Det vil hjælpe dig med at læse og skrive disse kemiske formler uden hele tiden at skulle henvise til tidligere afsnit.
Nu skal du se på reaktioner, der involverer grundstofferne hydrogen, kulstof og oxygen og forbindelserne metan, vand og kuldioxid.
Hydrogen vil reagere med oxygen, når det antændes (det er ret eksplosivt) for at danne vand. For at skrive en sådan reaktion i en kemisk ligning sættes de stoffer, der gennemgår reaktionen, til venstre, og de stoffer, der dannes ved reaktionen, sættes til højre. Reaktanterne til venstre forbindes med produkterne til højre ved hjælp af en pil.
Ligningen kan skrives som en ordligning “hydrogen og oxygen danner vand” eller, hvis man bruger lidt kemisk stenografi, kan den skrives som:

hvor pilen betyder “går til”.
Afprøv nu at bruge kemisk stenografi til at skrive ligningen. Ved at indsætte symboler i ordligningen får du:

Ligningen viser, at reaktanterne til venstre for pilen bliver omdannet til produktet til højre. Der er dog noget galt med denne ligning. Du kan se, hvad der er galt ved at se på figur 21, hvor reaktanterne og produkterne er vist som et diagram.
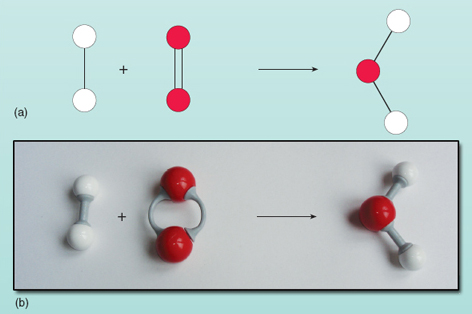
Tæller man antallet af atomer på hver side af ligningen, viser det sig, at der er to iltatomer til venstre i forhold til et til højre. Antallet af iltatomer på begge sider af ligningen skal være lige stort – de kan ikke på magisk vis dukke op og forsvinde under en reaktion. Det er ikke muligt at ændre sammensætningen af vandmolekylet til højre i ligningen, da vandmolekylet eksisterer som en gruppe bestående af to hydrogenatomer og et oxygenatom, der alle er bundet sammen. Hvert iltmolekyle leverer to iltatomer og vil derfor altid danne to vandmolekyler, forudsat at der er to brintmolekyler (som hver er en enhed bestående af to atomer) til at reagere med det. Der skal således to brintmolekyler og et iltmolekyle til for at danne to vandmolekyler. Reaktionen udtrykkes korrekt ved:

Der er nu det samme antal af hver type atom på begge sider af ligningen: den kemiske ligning er i balance, så vi kan nu erstatte pilen med et lighedstegn.
En sidste oprydning for at undgå gentagelse af brintmolekylerne til venstre i ligningen og vandmolekylerne til højre er at repræsentere dem med 2H2 i stedet for H2 + H2. Så den balancerede kemiske ligning bliver:

Dette er vist skematisk i figur 22.

Kemiske ligninger viser på en meget kortfattet måde ikke kun, hvilke atomer og molekyler der reagerer sammen for at danne produkterne, men også hvor mange af hver slags atomer og molekyler der er involveret. Det er vigtigt at huske, at det tal, der står foran et molekyle, betyder antallet af det pågældende molekyle. F.eks. betyder 3H2O tre vandmolekyler, hvilket giver i alt seks brint- og tre oxygenatomer.
Kemiske ligninger skal balancere; antallet af atomer af hver type grundstof på begge sider af ligningen skal være lige stort.
Du ved nu, hvordan du kan “læse” eller fortolke en kemisk ligning – og hvordan den repræsenterer en kemisk proces. Kemikere er imidlertid også meget dygtige til at skrive kemiske ligninger som en form for stenografi til at beskrive forskellige kemiske processer eller reaktioner. At skrive kemiske ligninger er som at skrive på et fremmedsprog – det kræver øvelse at blive flydende. Alle spirende videnskabsmænd er dog nødt til at starte et sted, og i afsnittet nedenfor vises det, hvordan man gør det ved hjælp af en meget velkendt kemisk reaktion. Hvis du vil undersøge, om du har brug for at studere dette afsnit, kan du prøve spørgsmål 20 først.