Svovltrioxid Kemiske egenskaber, anvendelser, produktion
Kemiske egenskaber
Svovltrioxid, S03, også kendt som svovlsyreanhydrid, nåle eller polymer, findes i en række modifikationer, der adskiller sig i molekylære arter og krystallinsk form. Det har en hvid, islignende modifikation, der smelter ved 16 °C (61 °F), og to andre som bestos-lignende former, der smelter ved de højere temperaturer på 33 og 62 °C (90 og 144 °F). Den farveløse væske- eller gasform har irriterende, giftige dampe og koger ved 45 °C (112 °F).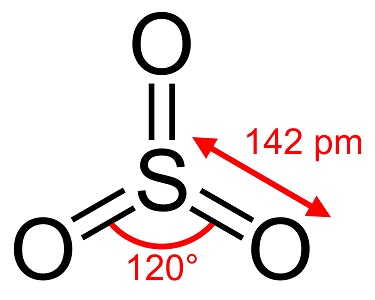
Svovltrioxid er et meget reaktivt stof, et stærkt oxidationsmiddel og en brandfare. Det reagerer med metaloxider for at danne sulfater og med vand for at danne svovlsyre. Svovltrioxid anvendes til sulfonering.
Fysiske egenskaber
Farveløs væske ved omgivelsestemperatur og atmosfærisk tryk; damper i luft.
Svovltrioxid har tendens til at polymerisere, især i tilstedeværelse af spor af vand eller svovlsyre. Polymerisationshastigheden falder imidlertid kraftigt, når dets frysepunkt nærmer sig. Fast (polymert) svovltrioxid findes i tre polymorfe faser: alfa-, beta- og gamma-modifikationer.
Alfafasen består af islignende nåle med en polymer tværbunden struktur. Den smelter ved 62,3 °C og har et damptryk på 73 torr ved 25 °C.
Betafasen er en metastabil allotrope med hvide, asbestlignende, skinnende nåle bestående af polymere molekyler, der smelter ved 32,5 °C og har et damptryk på 344 torr ved 25 °C.
Gamma-modifikationen kan ved almindelige temperaturer eksistere i fast eller flydende form. I fast form er det en kolloidal islignende masse, der smelter ved 16,8°C. I flydende form har den en massefylde på 1,9224 g/mL og koger ved 44,8°C. Det har et damptryk på 433 torr ved 25 °C. Gammafasen består af både cykliske trimer- og monomer-molekyler. Når fast svovltrioxid smelter, overgår det til sin gammafase, som ved størkning overgår til alfa-modifikation.
Kritisk temperatur for SO3 er 217,8°C; kritisk tryk 80,97 atm; kritisk massefylde 0,63 g/cm3; den dielektriske konstant for flydende SO3 ved 18°C er 3,11.
Svovltrioxid opløses i vand og danner svovlsyre og genererer stor varme.
Anvendelser
Svovltrioxid anvendes som mellemprodukt ved fremstilling af svovlsyre og oleum til sulfonering, især af farvestoffer og farvestoffer, og til fremstilling af vandfri salpetersyre og sprængstoffer. Svovltrioxid i fast form markedsføres under navne som Sulphan og Triosul og anvendes primært til sulfonering af organiske syrer. Svovltetrafluorid er et fluoriseringsmiddel. Svovlhexafluorid tjener som gasformig isolator i højspændingsinstallationer. Sulfyrylfluorid anvendes som insekticid og fumigant.
Sulfonering af organiske forbindelser, især nonioniske vaske- og rengøringsmidler, solenergikollektorer. Det produceres normalt i det anlæg, hvor det skal anvendes.
Produktionsmetoder
Svovltrioxid fremstilles som et mellemprodukt ved fremstilling af svovlsyre ved kontaktprocessen (se svovlsyre). Processen indebærer katalytisk oxidation af svovldioxid til trioxid.
Svovltrioxid fremstilles i laboratoriet ved at opvarme rygende svovlsyre, kondensere dampene og opsamle dem i en kølebeholder. Når dampene kondenseres under 27 °C i nærværelse af spor af fugt, dannes alle tre polymorfe faser af SO3. De kan adskilles ved fraktioneret destillation. Ved kondensation af dampene over 27 °C dannes den flydende variant af gamma-svovltrioxid.
Generel beskrivelse
Svovltrioxid er et farveløst til hvidt krystallinsk fast stof, der ryger i luft. Leveres ofte med inhibitor for at forhindre polymerisering. Svovltrioxid reagerer voldsomt med vand for at danne svovlsyre med frigivelse af varme. Svovltrioxid er ætsende over for metaller og væv. Svovltrioxid forårsager øjen- og hudforbrændinger. Indtagelse forårsager alvorlige forbrændinger i mund, spiserør og mave. Dampene er meget giftige ved indånding. Svovltrioxid udgør en brandrisiko ved kontakt med organiske materialer som f.eks. træ, bomuld, fiberplader osv.
Luft &Vand Reaktioner
Kombineres med vand med eksplosiv kraft og danner svovlsyre på grund af sin surhedsgrad Svovltrioxid forkuller de fleste organiske stoffer. Ved udsættelse for luft absorberer svovltrioxid hurtigt fugt og afgiver tætte hvide dampe .
Reaktivitetsprofil
Reaktionen mellem svovltrioxid og iltdifluorid er meget kraftig, og der opstår eksplosioner, hvis reaktionen udføres i fravær af et opløsningsmiddel . Reaktionen af svovltrioxid i overskud med tetrafluorethylen forårsager eksplosiv nedbrydning til carbonylfluorid og svovldioxid . Reaktionen af vandfri perchlorsyre med svovltrioxid er voldsom og ledsages af en betydelig varmeudvikling (Pascal 16:300 1931-34). Flydende svovltrioxid reagerer voldsomt med nitrylchlorid, selv ved 75° C. Reaktionen mellem svovltrioxid og blyoxid forårsager hvid luminescens . Kombinationen af jod, pyridin, svovltrioxid og formamid udviklede efter flere måneder en overtryksgas. Dette skyldes den langsomme dannelse af svovlsyre, fra eksternt vand eller dehydrering af formamid til hydrogencyanid.
Fare
Oxidationsmiddel, brandfare ved kontakt med organiske materialer, der opstår en eksplosiv stigning i damptrykket, når α-formen smelter. Anhydridetkombineres med vand og danner svovlsyre under udvikling af varme. Meget giftig, stærkt irriterende for væv.
Sundhedsfare
Svovltrioxid er meget giftigt. Det er irriterende og ætsende for slimhinderne. Giftig ved indånding eller indtagelse. Kontakt forårsager alvorlige forbrændinger på hud og øjne.
Brandfare
Brandfare ved kontakt med organiske materialer. Der opstår en eksplosiv stigning i damptrykket, når alfaformen smelter. Kombineres med vand med eksplosiv voldsomhed og danner svovlsyre. Kan antænde andre brændbare materialer (træ, papir, olie osv.). Brandfarlige giftige gasser kan ophobe sig i tanke og tragtevogne. Afstrømning til kloakken kan skabe brand- eller eksplosionsfare. Danner svovlsyre ved kontakt med vand. Undgå vand og organiske materialer. Ved udsættelse for luft absorberer svovltrioxid fugt og afgiver tætte hvide dampe.
Sikkerhedsprofil
Giftig ved indånding. Systemiske virkninger på mennesker ved indånding: hoste og andre lunge- og lugteforandringer. Et ætsende irritationsmiddel for hud, øjne og slimhinder. Voldsom reaktion med O2F2, PbO, NClO2, HClO4, P, tetrafluorethylen, acetonitril, svovlsyre, dimethylsulfoxid, dioxan, vand, diphenylkviksølv, formamid, jod, pyridin, metaloxider. Reagerer med damp og danner ætsende, giftige svovlsyredampe. Ved opvarmning til nedbrydning afgiver det giftige dampe af SO,. Se også svovlsyre.
Potentiel eksponering
Svovltrioxid anvendes som sulfaterings- og sulfoneringsmiddel i vaske- og rengøringsmidler, smøreolieadditiver og andre organiske forbindelser; i solfangere. Det anvendes også som et mellemprodukt ved fremstilling af svovlsyre og ved fremstilling af sprængstoffer.
oplagring
Svovltrioxidets damptryk stiger hurtigt med stigende temperatur, og når α-formen smelter, er trykstigningen eksplosiv; transport- og lagerbeholdere skal derfor kunne modstå et tryk på 10-15 atm. Svovltrioxid reagerer kraftigt og stærkt eksotermisk med vand under dannelse af svovlsyre. Når det udsættes for fugtig luft, ryger det og danner en tåge af svovlsyre, som efterhånden fylder hele det tilgængelige rum; det ætser også metaller. Det er et kraftigt oxidationsmiddel og i flydende fase carboniserer det organiske materialer.
Sendelse
UN1829 Svovltrioxid, stabiliseret, Fareklasse: 8; Etiketter: 8 – Ætsende materiale, 6.1 – Gift ved indånding, fare ved indånding, farezone B.
Inkompatibiliteter
Brændbart og ætsende. Et stærkt oxidationsmiddel. Reagerer voldsomt med vand, damp eller fugt og frigiver ætsende svovlsyre. Voldsomme reaktioner opstår ved kontakt med stærke baser; stærke syrer, kemisk aktive metaller; reduktionsmidler; fint opdelt metal; cyanider, nitrater, picrater, fulminater, chlorater, sulfider, carbider, fosfor, dioxygen difluorid, bariumoxid; blyoxid; diphenylkviksølv; alkoholer, nitrylchlorid; acetonitril, dioxan, tetrafluoroethylen.
Bortskaffelse af affald
Returnerer genopfyldelige komprimerede gasflasker til leverandøren. Flasker, der ikke kan genopfyldes, skal bortskaffes i overensstemmelse med lokale, statslige og føderale bestemmelser. Lad den resterende gas langsomt blive udluftet til atmosfæren i et ubegrænset område eller i en emhætte. Genopfyldelige flasker skal returneres til den oprindelige leverandør med eventuelle ventilhætter og udløbspropper fastgjort og med ventilbeskyttelseshætter på plads.