Denne struktur opstår, når to (eller flere, f.eks. ψ-loop) segmenter af en polypeptidkæde overlapper hinanden og danner en række af hydrogenbindinger med hinanden. Dette kan ske i et parallelt arrangement:

Og i et antiparallelt arrangement:
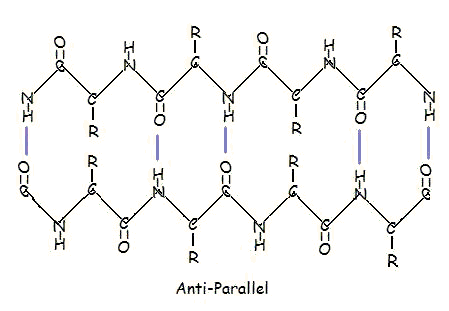
Parallelt og antiparallelt arrangement er den direkte konsekvens af polypeptidkædens retningsbestemthed. Ved antiparallel anbringelse er C-terminus-enden af det ene segment på samme side som N-terminus-enden af det andet segment. I parallelt arrangement er C-terminus-enden og N-terminus-enden på samme side for begge segmenter. “Foldningen” opstår på grund af de skiftende planer for peptidbindingerne mellem aminosyrerne; den justerede amino- og carbonylgruppe i hvert modsatte segment skifter deres orientering fra at vende mod hinanden til at vende i modsatte retninger.
Den parallelle anordning er mindre stabil, fordi geometrien af de enkelte aminosyremolekyler tvinger hydrogenbindingerne til at forekomme i en vinkel, hvilket gør dem længere og dermed svagere. I modsætning hertil er hydrogenbindingerne i det antiparallelle arrangement rettet direkte modsat hinanden, hvilket giver stærkere og mere stabile bindinger.
Sædvanligvis dannes der et antiparallelt beta-plisseret ark, når en polypeptidkæde vender skarpt om i retning. Dette kan ske ved tilstedeværelse af to på hinanden følgende prolinrester, som skaber et vinklet knæk i polypeptidkæden og bøjer den tilbage på sig selv. Dette er ikke nødvendigt for fjerntliggende segmenter af en polypeptidkæde for at danne beta-plisserede ark, men for proximale segmenter er det et ufravigeligt krav. Ved korte afstande er de to segmenter i et beta-plisseret ark adskilt af 4+2n aminosyrerester, idet 4 er det mindste antal rester.