Har du nogensinde undret dig over, hvorfor glødepinde (se fig. 1) lyser, når du har bøjet dem? Eller hvorfor disse plastikstjerner stadig lyser om natten, efter at lyset er blevet slukket? Det har du måske ikke. Men uanset om du har stillet dig selv disse spørgsmål eller ej, vil den følgende tekst forhåbentlig give dig svar og forklaringer på fænomenerne glødearmbånd, lysende vandmænd, sort lys og meget andet.

Figur 1. Glødestænger.
Luminescens
Generelt kaldes det glød, der opstår i alle de førnævnte fænomener, for luminescens. Luminescens er energi, der frigives af et stof i form af lys . Der kan skelnes mellem flere typer af luminescens:
- Et eksempel er kemiluminescens. Under nogle kemiske reaktioner frigives energi i form af lys. Dette sker efter bøjning af en glødestok. Det er også årsagen til, at dyr som f.eks. vandmænd eller visse mikroorganismer lyser. I dette tilfælde kaldes det bioluminescens .
- En anden slags er triboluminescens. Den kan iagttages, når en selvklæbende kuvert åbnes i fuldstændig mørke, eller når klæbebånd rulles ud i et mørkt rum. Herved tilføres mekanisk energi til systemet og tjener som en aktivator for gløden .
- Den mest kendte type luminescens er nok fotoluminescens. Her tilvejebringes energien af elektromagnetisk stråling, f.eks. gennem sollys eller en ultraviolet lampe, som i nogle diskoteker. Dette forårsager fænomener som f.eks. den vedvarende glød fra plastikstjerner eller den ekstreme lysstyrke af hvidt tøj under sort lys. Man kan skelne mellem fluorescens og fosforescens, hvilket vil blive forklaret nedenfor .
Hvad er en elektronisk exciteret tilstand?
Generelt er alle former for luminescens baseret på såkaldte fotofysiske processer. Normalt beskrives molekyler selv som fluorescerende. Dette er tilfældet med fluorescerende farvestoffer som f.eks. fluorescein eller curcumin . For at forklare fotofysiske processer må man imidlertid se nærmere på et endnu mindre niveau end det molekylære.
Atomer fra forskellige grundstoffer har et forskelligt antal elektroner fordelt på flere skaller og orbitaler. Elektroner er en type elementarpartikler. Elektroniske overgange er ansvarlige for luminescens . Når systemet absorberer energi, bliver elektronerne exciteret og løftes op i en højere energetisk tilstand. Før excitationen, i grundtilstanden, befinder nogle af elektronerne sig i den såkaldte HOMO (Highest Occupied Molecular Orbital). Efter at de har nået en exciteret tilstand, befinder de sig i LUMO-området (Lowest Unoccupied Molecular Orbital) (se fig. 2). Hvordan dette præcist fungerer, vil blive forklaret ved hjælp af fotoluminescens som et konkret eksempel.

Figur 2. Elektronisk excitation.
De forskellige energitilstande i et atom eller molekyle er kendt som “energiniveauer”. Afhængigt af molekylet og atomet kan elektronerne kun indtage diskrete energiniveauer, da energien er kvantiseret, hvilket betyder, at energi kun kan absorberes og udsendes i bestemte mængder . Forskellen mellem to niveauer kan beregnes med ligning 1 (hvor E2 er det højere energiniveau og E1 det lavere).
(1) ΔE = E2-E1
Photoner, partikler, som elektromagnetisk stråling eller lys består af, skal have en bestemt energiværdi for at kunne excitere elektroner. En fotons energi kan beregnes med ligning 2, hvor h er Planck-konstanten og ν er lysets frekvens.
(2) Ephoton = hν
Den nødvendige excitationsenergi for elektronerne er lig med forskellen mellem energiniveauerne. Kun lys med en bestemt energi og følgelig med en bestemt frekvens og bølgelængde er i stand til at excitere elektroner . Ved at sidestille ligning 1 og 2 og ved hjælp af ligning 3 (hvor c står for lysets hastighed) kan man beregne den nødvendige frekvens og bølgelængde (se ligning 4) . I mange tilfælde anvendes UV-stråling til excitering.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Deaktivering af elektronisk exciterede tilstande
Sådanne elektronisk exciterede tilstande er ustabile. Elektronerne falder tilbage til deres grundtilstande. Samtidig frigøres excitationsenergien igen. Man skelner mellem radiative og ikke-radiative henfaldsprocesser. For det meste er henfaldet ikke-radiativt, f.eks. gennem vibrationsrelaksation, quenching med omgivende molekyler eller intern konvertering (IC) . Disse processer vil blive forklaret nærmere senere.
I nogle tilfælde kan der forekomme et strålende henfald i form af fluorescens og fosforescens. Energien udsendes som elektromagnetisk stråling eller fotoner. Det udsendte lys har en længere bølgelængde og en lavere energi end det absorberede lys, fordi en del af energien allerede er blevet frigivet i en ikke-radiativ henfaldsproces . Dette er grunden til, at en emission i det synlige spektrum kan opnås ved excitering med ikke-synlig UV-stråling. Dette skift til en længere bølgelængde kaldes Stokes-skift .
Sammenligning: Fluorescens vs. fosforescens
Både fluorescens og fosforescens er spontane emissioner af elektromagnetisk stråling. Forskellen er, at fluorescensens glød stopper lige efter, at kilden til excitatorisk stråling er slukket, mens der for fosforescens kan forekomme en efterglød med varigheder på brøkdele af et sekund og op til timer .
For at sammenligne de fotofysiske processer bag de to fænomener er der nogle fakta om elektroner, som er nyttige for forståelsen: Elektroner er partikler, der har et såkaldt spin og et spinkvantetal. Dette kan have to forskellige værdier, nemlig enten +1/2 eller -1/2 . Dette tal er en egenskab, som vi faktisk ikke kan forestille os eller beskrive let. Det sammenlignes ofte med en snurretop, der enten snurrer med eller mod uret. Denne beskrivelse er imidlertid hverken matematisk eller fysisk helt korrekt. To elektroner i et enkelt orbital i et atom har antiparallelt spin, hvilket noteres som (↓) .
Fluorescens
I Jablonski-diagrammet for fluorescens (se fig. 3) er singlet-spintilstanden S0 elektronernes grundtilstand, og S1 og S2 er singlet-anspændte tilstande (tilstandene bruges kun som eksempel i denne tekst og gælder ikke nødvendigvis for bestemte atomer, molekyler osv.) ). Inden for disse tilstande findes der flere energiniveauer. Jo højere niveauet er, jo mere energi besidder en elektron, når den befinder sig i det pågældende niveau. I tilfælde af singlettilstande har elektronerne antiparallelle spins.

Figur 3. Jablonski-diagram for fluorescens.
Elektronerne løftes fra grundtilstanden S0, f.eks. til et energiniveau i den anden exciterede tilstand S2, når de exciteres af elektromagnetisk stråling. Efter at exciteringen er ophørt, forbliver elektronerne kun i denne exciterede tilstand i kort tid (ca. 10-15 s) og begynder derefter straks at falde tilbage til grundtilstanden . Herved kan der i første omgang frigives energi til omgivelserne ved vibrationsrelaksation. Det vil sige, at termisk energi frigives ved atomets eller molekylets bevægelse, indtil det laveste niveau i den anden exciterede tilstand er nået.
Den større kløft mellem den anden og den første exciterede tilstand overvindes ved intern omdannelse. Det beskriver en elektronisk overgang mellem to tilstande, mens elektronernes spin bevares. Nu kan elektronerne slappe yderligere af på grund af mere vibrationsrelaksation, indtil de når det laveste energiniveau i S1-tilstanden.
Theoretisk set kan elektronerne slappe endnu mere af på en ikke-radiativ måde, indtil de til sidst når grundtilstanden igen. Det kan dog ske, at den sidste energimængde er for stor til at blive frigivet til omgivelserne, fordi de omgivende molekyler ikke kan optage så meget energi. I så fald opstår der fluorescens, hvilket fører til en emission af fotoner med en bestemt bølgelængde. Emissionen varer kun, indtil elektronerne er tilbage i grundtilstanden. Da elektronernes spin forbliver det samme under alle disse overgange, beskrives de som spin-tilladte.
Fosforescens
For fosforescens er tingene en smule anderledes (se fig. 4). Der er igen en S0 grundtilstand og de to exciterede tilstande, S1 og S2. Derudover er der en exciteret triplet T1-tilstand, som energimæssigt ligger mellem S0- og S1-tilstanden. Elektronerne har igen antiparallelle spins i grundtilstanden.
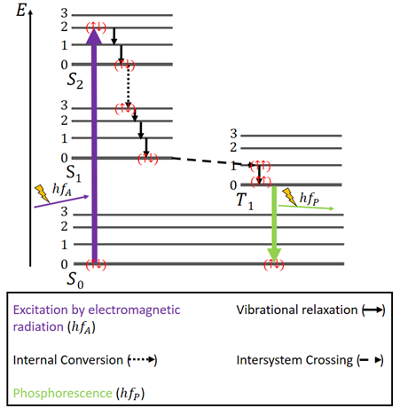
Figur 4. Jablonski-diagram for fosforescens.
Ekscitering sker på samme måde som ved fluorescens, nemlig gennem elektromagnetisk stråling. Frigivelsen af energi gennem vibrationsrelaksation og intern omdannelse med bibeholdelse af samme spin foregår også her på samme måde, men kun indtil S1-tilstanden er nået.
Suden singlettilstandene findes en triplettilstand, og såkaldt intersystem crossing (ISC) kan forekomme, da T1-tilstanden er energimæssigt mere gunstig end S1-tilstanden. Denne krydsning er, ligesom intern konvertering, en elektronisk overgang mellem to exciterede tilstande. Men i modsætning til intern konvertering er ISC forbundet med en spinomvending fra singlet til triplet. Elektroner i triplettilstanden har parallelle spins, hvilket er noteret som () . Denne ISC-proces beskrives som “spin-forbudt”. Den er ikke helt umulig – på grund af et fænomen kaldet “spin-orbit-kobling” – men den er dog ret usandsynlig .
I T1-tilstanden er ikke-radiativt henfald også muligt. En overgang mellem triplettilstandens laveste energiniveau og S0-tilstanden er dog ikke umiddelbart mulig, da denne overgang også er spinforbudt. Alligevel kan det alligevel ske med en lille mulighed. Det medfører en ret svag udsendelse af fotoner, fordi elektronens spin skal vendes igen. Energien er fanget i denne tilstand i et stykke tid og kan kun frigives langsomt . Når al energien er frigivet, er elektronerne tilbage i grundtilstanden.
Konklusion
De spin-godkendte og -forbudte processer tjener som forklaringer på et umiddelbart ophørende lysglimt ved fluorescens og på eftergløden ved fosforescens. Fosforescens forekommer normalt kun med “tungere” molekyler, da spin skal vendes ved hjælp af spin-orbit-kobling. Hvorvidt der overhovedet udsendes elektromagnetisk stråling, og med hvilken bølgelængde, afhænger af, hvor meget energi der på forhånd kan frigives ved ikke-radiativt henfald . Det afhænger også af egenskaberne hos såkaldte quenchere, som er omgivende molekyler, der kan optage større mængder energi.
Alle processer, der kan føre til en hæmning af strålende henfald, kan forårsage fluorescensdæmpning. Eksempler er ikke-radiative henfaldsprocesser, men også ødelæggelse af det fluorescerende molekyle . Kvanteeffektiviteten beskriver processens effektivitet og er defineret som forholdet mellem absorberede og udsendte fotoner . Denne egenskab er forskellig for hvert stof.
Selv om denne tekst fokuserer på fotoluminescens, er de fotofysiske processer de samme for alle typer luminescens .
Anvendelsesområder
Ud over produkter som glødestænger anvendes fluorescens og fosforescens på mange andre måder. Andre eksempler er vejvisere, der fører til en nødudgang, og som ikke behøver nogen elektrisk forsyning, men som lyser om natten på grund af fosforescens. Selv planter kan gøres fluorescerende: Spinat kan modificeres ved hjælp af nanoteknologi, så den kan afsløre spor af eksplosive stoffer i grundvandet. Bladene indeholder kulstofnanorør, som nitroaromatiske stoffer kan binde sig til. Hvis de gør det, frigives et fluorescerende signal af planten, som kan detekteres med infrarøde kameraer.
Videoen demonstrerer forskellige typer luminescens. I venstre side viser den fluorescensen af farvestoffet curcumin, som er indeholdt i krydderiet gurkemeje, under UV-lys . Curcumin er opløst i alkohol for at gøre fluorescensen synlig.
Plastikedderkoppen og forbindelsen i det lille rør er eksempler på fosforescens. Strontiumaluminat, som er indeholdt i røret, bliver i første omgang exciteret af UV-stråling og udsender til sidst grønt lys. Årsagen hertil er en dotering med grundstoffer som europium, som gør forbindelsen anvendelig som et luminescerende pigment .
Bøjning af glødestokken (i højre side) sætter en kemisk reaktion i gang mellem hydrogenperoxid og et farvestof og phenyloxalat. Der kan observeres kemiluminescens.
Video 1. Fluorescens, fosforescens og kemiluminescens i sammenligning.
K. Arnold et al., Chemie Oberstufe (på tysk), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (på tysk), spektrum.de. (besøgt den 25. januar 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (på tysk), chemieunterricht.de 2010. (besøgt 25. januar 2017)
Lexikon der Physik: Photophysikalische Prozesse (på tysk), spektrum.de. (besøgt 27. januar 2017)
D. Wiechoczek, Chemie mit Curry (på tysk), chemieunterricht.de 2015. (besøgt 27. januar 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (på tysk), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (på tysk), chemie.de. (besøgt 27. januar 2017)
Bohr-frekvensrelation (på tysk), chemgapedia.de. (besøgt den 25. januar 2017)
Ilmenau University of Technology, Praktisk kursus i fysisk kemi II: Fysisk kemi/mikroreaktionsteknologi, Fluorescensudslukningsforsøg (på tysk), tu-ilmenau.de. (besøgt 27. januar 2017)
Stokes-skift (på tysk), chemie.de. (besøgt 25. januar 2017)
Elektronspin (på tysk), chemie.de. (besøgt 27. januar 2017)
Kvanteudbytte (på tysk), chemie.de. (besøgt 27. januar 2017)
Spinat opdager sprængstoffer i grundvand (på tysk), Spiegel Online, 1. november 2016. (besøgt 27. januar 2017)
D. Weiß, Phosphorescence (på tysk), chemie.uni-jena.de. (besøgt den 27. januar 2017)
 Kim Dreier er elev på Marianne-Weber-Gymnasium (gymnasium) i Lemgo, Tyskland.
Kim Dreier er elev på Marianne-Weber-Gymnasium (gymnasium) i Lemgo, Tyskland.