Generelle egenskaber ved salte
Nogle af de karakteristiske egenskaber ved salte er:
- Smelte- og kogepunkt: Salte er for det meste faste stoffer, som både smelter og koger ved høje temperaturer.
- Opløselighed i vand: Salte er generelt opløselige i vand. F.eks. er natriumklorid, kaliumsulfat, aluminiumnitrat, ammoniumcarbonat osv. opløselige salte, mens sølvklorid, blyklorid, kobbercarbonat osv. er uopløselige i vand.
- Krystalliseringsvand: Generelt findes salte som krystaller med vandmolekyler til stede i dem. Dette vand kaldes krystalvand, og sådanne salte kaldes hydrerede salte.
F.eks. har kobbersulfatkrystal fem vandmolekyler for hvert kobbersulfatmolekyle. Dette skrives som CuSO4.5H2O. Dette krystalliseringsvand giver krystallen sin form. Det giver også farve til nogle krystaller. Ved opvarmning mister hydrerede salte deres krystalvand, og som følge heraf mister krystallerne deres form og farve og bliver til et pulverformet stof.
De hydrerede salte, der har mistet deres krystalvand, kaldes vandfrie salte.
Når hydreret kobbersulfat opvarmes, afgiver det vandmolekyler og danner hvidt pulverformet vandfrit kobbersulfat. Ved tilsætning af vand kan dette stof igen omdannes til en hydreret kobbersulfatopløsning igen.
Mennesker spørger også
- Klassifikation af salte
- Anvendelse af forskellige salte i dagligdagen
- Fremstilling af salte
- Beskriv fremstillingen af opløselige og uopløselige salte
- Kvalitativ Analyse af salte
- Varmepåvirkning af salte
- Test for kationer og anioner i vandige opløsninger
- Konstruktion af ioniske ligninger ved hjælp af den kontinuerlige variationsmetode
- Hvad er støkiometri, og hvorfor bruges den i kemi?
Generelle egenskaber ved salte :
1. Reaktion med en syre : Når et salt reagerer med en syre, dannes der et andet salt og en anden syre. Når natriumklorid opvarmes med svovlsyre, dannes der f.eks. først natriumhydrogensulfat (ved lav temperatur) og derefter natriumsulfat (ved høj temperatur), og der udvikles hydrogenkloridgas.
2. Reaktion med en base : Et salt reagerer med en base og danner et andet salt og en base.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reaktion med et metal : Nogle gange kan en saltopløsning reagere med et metal. Når et jernsøm f.eks. dyppes i en vandig opløsning af kobbersulfat, aflejres kobberet på sømmenes overflade, mens det dannede jernsulfat forbliver i opløsningen.
CuSO4 + Fe → FeSO4 + Cu
Denne reaktion viser, at jern er mere reaktivt end kobber.
Det mere reaktive metal kan således fortrænge et mindre reaktivt metal fra en opløsning af dets salt.
4. Salts adfærd over for vand :
Når et salt er opløst i vand, kan opløsningen være neutral, sur eller basisk. Dette afhænger af arten af det anvendte salt.
(i) Et normalt salt, der er fremstillet af en stærk syre og en stærk base, giver en neutral opløsning. F.eks. er de vandige opløsninger af NaCl og K2SO4 neutrale over for lakmus.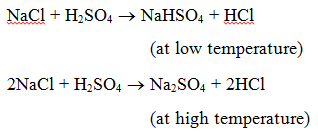
(ii) Et normalt salt, der er afledt af en svag syre og en stærk base, giver en alkalisk opløsning. Eksempelvis er vandige opløsninger af både natriumcarbonat (Na2CO3) og natriumacetat (CH3COONa) alkaliske.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Et salt, der er afledt af en stærk syre og en svag base, giver en sur opløsning. F.eks. giver både aluminiumklorid (AlCl3) og ammoniumklorid (NH4Cl) sure vandige opløsninger.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Opløsninger af sure salte er sure over for lakmus, dvs. at disse opløsninger gør blåt lakmuspapir rødt. F.eks. bliver en opløsning af natriumhydrogensulfat (NaHSO4) blå lakmuspapir rødt.
Natriumhydrogencarbonat (NaHCO3)-opløsning er derimod svagt alkalisk.