Aspartataminotransferaseaf Luke Spooner
Indhold
- 1 Funktion
- 2 Struktur
- 3 Funktion
- 4 Kliniske anvendelser
- 5 3D-strukturer af aspartataminotransferase
Funktion
Aspartataminotransferase (AAT), også kendt som glutamisk aspartat transaminase, glutamisk oxaloacetat transaminase, prephenat aminotransferase og transaminase A er et enzym, der er et medlem af klasse-I pyridoxalphosphat-afhængig aminotransferase-familien . Det er kodet af genet GOT1. Det er en homodimer, der er 413 aminosyrer lang og spiller en kritisk rolle i aminosyre- og kulhydratmetabolismen, ureogenese og overførsel af reducerende ækvivalenter til mitokondrier og kloroplast. I prokaryote celler findes den udelukkende i cytosolen, men i eukaryote celler findes der isozymer i cytosol, mitokondrier og kloroplast. Bifunktionel aspartataminotransferase (BAAT) er nødvendig for transaminering af præfanat til arogenat.
I menneskekroppen produceres det i hjernen, skeletmuskulaturen, leveren, bugspytkirtlen, de røde blodlegemer og nyrerne . Den brede vifte af væv, hvori det fremstilles, adskiller det fra det lignende enzym alanintransaminase (ALT), som primært findes i leveren. Niveauet af AAT i kroppen kan bruges som en markør for vævssygdomme eller -skader. Desuden kan AAT- og ALT-niveauerne sammenlignes for at fastslå, om vævsskader primært findes i leveren.
Struktur
der indeholder (Alpha-helixer, betastrenge , sløjfer , drejninger). Asymmetrisk enhed af Aspartat aminotransferase, med fremhævet lille og stort domæne og PLP-kofaktor (1b4x). Hver underenhed indeholder et tilsvarende aktivt sted. Underenhederne er forbundet på to steder: mellem deres store domæner og mellem de N-terminale rester og det store domæne på den anden underenhed. Denne struktur af AST varierer meget fra organisme til organisme, lige fra E. coli til mennesker. Desuden er strukturen af det aktive sted meget velbevaret med en sekvenshomologi på 25 %.
Hver underenhed af homodimeren er yderligere opdelt i et lille og et stort domæne. Den består af aminosyrerne fra N-terminus til Pro 48-residuen og fra Met 326 til C-terminus. De resterende aminosyrer udgør den , og den er forbundet af en lang α-helix bestående af 32 aminosyrer.
Det store domæne er det sted, hvor AAT’s aktive sted findes, og for at rumme dette indeholder kernen mange α/β-supersekundære strukturer. Dette står i kontrast til kernen af den lille underenhed, som er dannet af to α-helixer og to β-strenge. I flercellede organismer er der et knæk ved den 325. rest, der fungerer som et hængsel for det lille domæne, hvilket giver mulighed for de deraf følgende konformationsændringer, der finder sted ved binding af inhibitorer til enzymet.
Som nævnt ovenfor er det aktive sted for AST placeret på det store domæne af underenheden. Inden for det aktive sted findes aminorest Lys 258, også kendt som den interne aldimin, som binder sig til cofaktoren Pyridoxal 5′-phosphat () og danner det, der kaldes en Schiff-base. Ved tilsætning af et aminosyresubstrat dannes der en ny Schiff-base mellem PLP og aminosyren.
Funktion
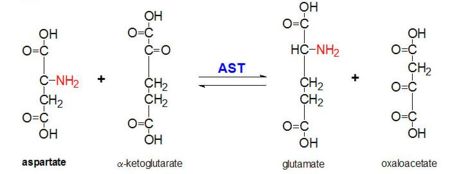
Figur 2: Transaminationsreaktion af L-aspartat og α-ketoglutarat katalyseret af aspartataminotransferase
AAT katalyserer den reversible transaminering af α-aminogruppen fra L-aspartat til α-ketoglutarat, der danner oxaloacetat og glutamat. Denne reaktivitet er lavere i E.coli end i højere eukaryoter og har en bredere substratspecificitet. Reaktionen finder dog sted på samme måde. Ved introduktion af et aminosyresubstrat dannes der en ny Schiff-base mellem det og PLP-kofaktoren. Dette medfører, at aminosyren mister et hydrogen og danner et quinoidintermediat, og reprotaneringen finder sted, hvilket resulterer i en ketimin. Dernæst hydrolyseres strukturen og danner en α-ketosyre og pyridoxaminphosphat. 2-methylaspartat virker som en inhibitor af AAT, når det danner en Schiif-base med PLP-kofaktoren, snarere end aspartat. Dette resulterer i, at processen stopper ved det trin, der går forud for alfaproteinudskillelsen.
Denne reaktion er afgørende for opretholdelse af homøostase i organismer. De fire forskellige molekyler, der kan dannes som følge af denne transanimation (oxaloacetat, α-ketoglutarat, aspartat, L-glutamat), vores kritiske for en række metaboliske processer. Oxaloacetat og α-ketoglutarat spiller en kritisk rolle i Krebs-cyklus, varierende former af aspartat er vigtige molekyler i urinstofcyklusen og deltager i glukoneogenese, og glutamat er et vigtigt molekyle i metaboliske veje forbundet med hukommelse.
Kliniske anvendelser
Niveauerne af AAT i kroppen er tegn på vævsskader og sygdom. Normalt findes AAT i minimale mængder i blodet, men når de ovenfor nævnte organer beskadiges, frigives AAT i blodet. Den mængde, der frigives, er proportional med omfanget af den påførte skade. Det er blevet påvist, at AAT-niveauerne stiger betydeligt inden for 6 timer efter den første vævsnedbrydning og kan forblive forhøjet i op til 4 dage. Når AAT-niveauerne sammenlignes med niveauerne af andre enzymer, kan lægerne bruge dem til at bestemme, hvor i kroppen skaden har fundet sted. Sammenligninger med ALT har vist sig at være særligt nyttige til at identificere leverskader som f.eks. skrumpelever og hepatitis. Under normale forhold er AAT-niveauet hos mænd 6-34 IU/L og hos kvinder 8-40 IU/L.
3D-strukturer af aspartataminotransferase
Aspartataminotransferase 3D-strukturer