Læringsmål
- At identificere og navngive simple (retkædede) alkaner givet ved hjælp af formler og skrive formler for retkædede alkaner givet ved hjælp af deres navne.
Vi begynder vores studier af organisk kemi med kulbrinterne, de enkleste organiske forbindelser, som kun består af kulstof- og hydrogenatomer. Som vi bemærkede, findes der flere forskellige slags kulbrinter. De adskiller sig fra hinanden ved de typer af bindinger mellem kulstofatomerne og de egenskaber, der følger af disse bindinger. Kulbrinter, der kun har enkeltbindinger fra kulstof til kulstof (C-C) og eksisterer som en kontinuerlig kæde af kulstofatomer, der også er bundet til hydrogenatomer, kaldes alkaner (eller mættede kulbrinter). Mættet betyder i dette tilfælde, at hvert kulstofatom er bundet til fire andre atomer (brint eller kulstof) – det mest mulige; der er ingen dobbelt- eller trippelbindinger i molekylerne.
Ordet mættet har samme betydning for kulbrinter som for fedtstoffer og olier i kosten: Molekylet har ingen kulstof-til-kulstof-dobbeltbindinger (C=C).
Vi har tidligere præsenteret de tre enkleste alkaner – methan (CH4), ethan (C2H6) og propan (C3H8) – og de er igen vist i figur \(\PageIndex{1}\).
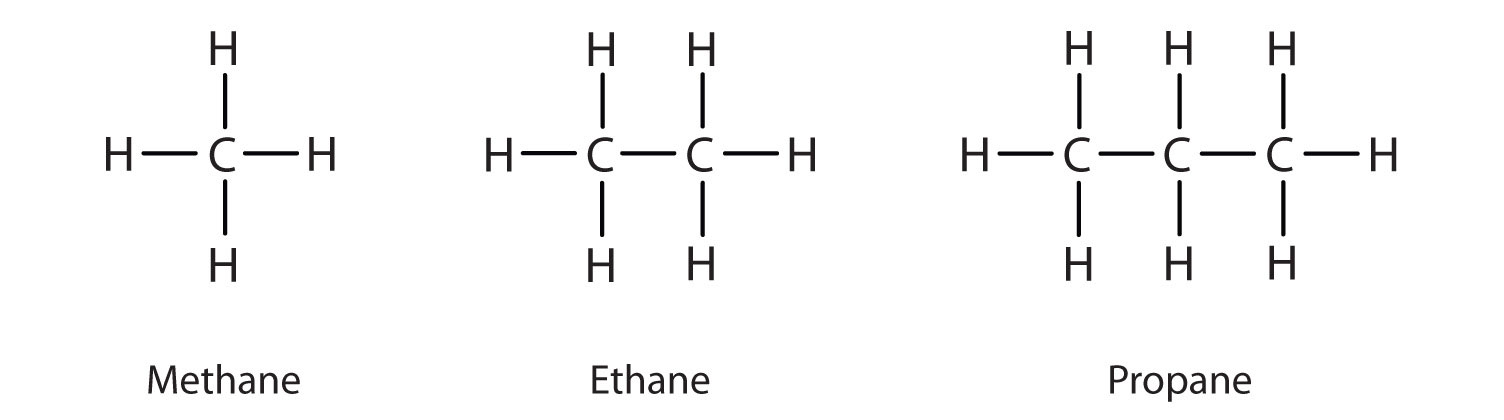
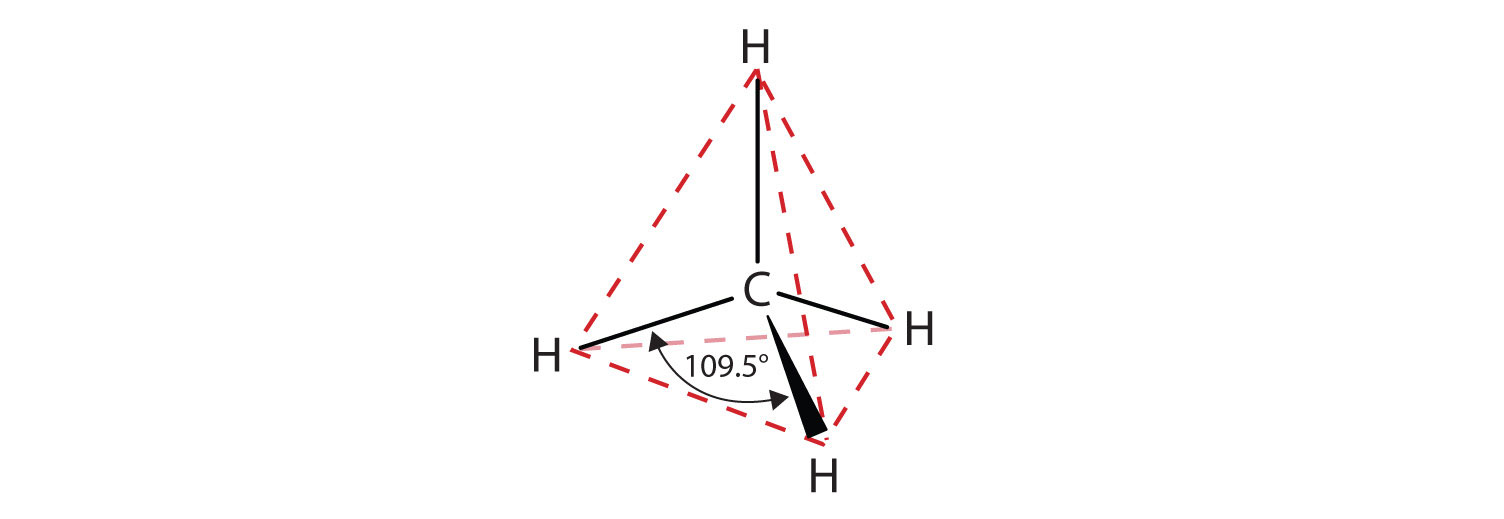
De viste flade repræsentationer gengiver ikke nøjagtigt bindingsvinkler eller molekylær geometri. Metan har en tetraedrisk form, som kemikere ofte afbilder med kiler, der angiver bindinger, der kommer ud mod dig, og stiplede linjer, der angiver bindinger, der går tilbage væk fra dig. En almindelig gennemgående linje angiver en binding i sidens plan. Husk, at VSEPR-teorien korrekt forudsiger en tetraedrisk form for metanmolekylet (Figur \(\PageIndex{2}\)).
Metan (CH4), ethan (C2H6) og propan (C3H8) er begyndelsen på en serie af forbindelser, hvor to medlemmer i en rækkefølge adskiller sig fra hinanden med et kulstofatom og to hydrogenatomer – dvs. en CH2-enhed. De første 10 medlemmer af denne serie er angivet i tabel \(\PageIndex{1}\).
| Navn | Molekylformel (CnH2n + 2) | Kondenseret strukturformel | Antal af Mulige isomerer |
|---|---|---|---|
| methan | CH4 | CH4 | – |
| ethan | C2H6 | CH3CH3CH3 | – |
| propan | C3H8 | CH3CH3CH2CH3 | – |
| butan | C4H10 | CH3CH3CH2CH2CH2CH3 | 2 |
| pentan | C5H12 | CH3CH3CH2CH2CH2CH2CH3 | 3 |
| hexan | C6H14 | CH3CH3CH2CH2CH2CH2CH2CH3 | 5 |
| heptan | C7H16 | CH3CH3CH2CH2CH2CH2CH2CH2CH3 | 9 |
| oktan | C8H18 | CH3CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH3 | 18 |
| nonan | C9H20 | CH3CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH3 | 35 |
| decan | C10H22 | CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH3 | 75 |
Opmærksomheden henledes på serien i figur \(\PageIndex{3}\). Sekvensen starter med C3H8, og der tilføjes en CH2-enhed i hvert trin opad i serien. Enhver familie af forbindelser, hvor tilstødende medlemmer adskiller sig fra hinanden ved en bestemt faktor (her en CH2-gruppe), kaldes en homogen serie. Medlemmerne af en sådan serie, kaldet homologe, har egenskaber, der varierer på en regelmæssig og forudsigelig måde. Homologiprincippet organiserer den organiske kemi på samme måde, som det periodiske system organiserer den uorganiske kemi. I stedet for en forvirrende række af individuelle kulstofforbindelser kan vi studere nogle få medlemmer af en homolog serie og ud fra dem udlede nogle af egenskaberne for andre forbindelser i serien.
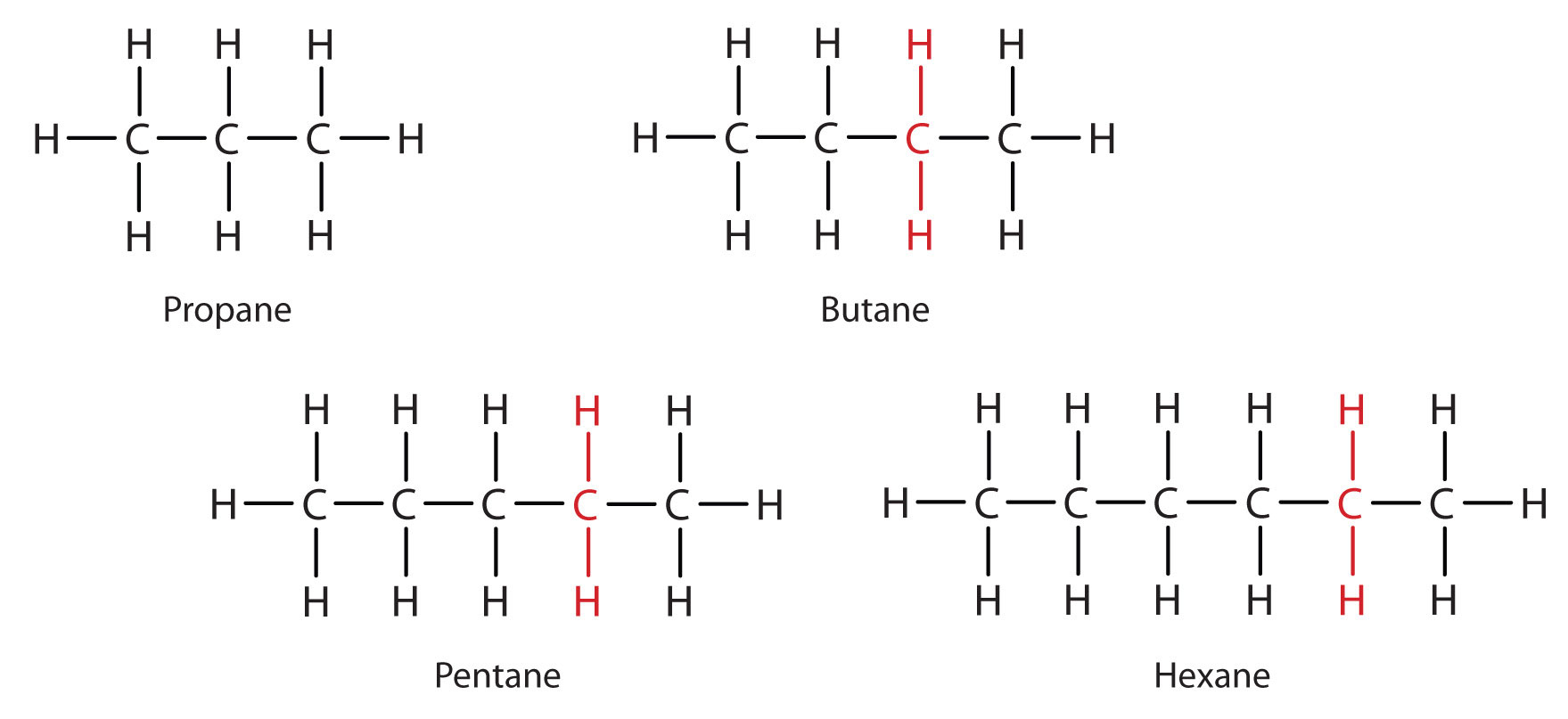
Princippet om homologi giver os mulighed for at skrive en generel formel for alkaner: CnH2n + 2. Ved hjælp af denne formel kan vi skrive en molekylformel for en hvilken som helst alkan med et givet antal kulstofatomer. F.eks. har en alkan med otte kulstofatomer molekylformlen C8H(2 × 8) + 2 = C8H18.
Nøgleudtryk
- Enkle alkaner eksisterer som en homolog serie, hvor tilstødende medlemmer adskiller sig ved en CH2-enhed.