Billeder i kemiske reaktioner
I dette kapitel vil vi lære om nogle reaktioner, hvor de vigtigste trin involverer flytning af enkelte elektroner. Du husker måske fra helt tilbage i afsnit 6.1A, at enkeltelektroners bevægelse er afbildet med en pil med en enkeltbøjede “fiskekrog” (i modsætning til de velkendte dobbeltbøjede pile, som vi har brugt i hele bogen til at vise toelektroners bevægelse).

Enkelelektronmekanismer indebærer dannelse og efterfølgende reaktion af frie radikale arter, meget ustabile mellemprodukter, som indeholder en uparret elektron. Vi vil i dette kapitel lære, hvordan frie radikaler ofte dannes ved homolytisk spaltning, en begivenhed, hvor de to elektroner i en brydning af en kovalent binding bevæger sig i modsatte retninger

(I modsætning hertil involverer stort set alle de reaktioner, vi har studeret indtil nu, bindingsbrydende begivenheder, hvor begge elektroner bevæger sig i samme retning: dette kaldes heterolytisk spaltning).
Vi vil også lære, at mange enkeltelektronmekanismer tager form af en radikal kædereaktion, hvor et radikal forårsager dannelsen af et andet radikal, som igen forårsager dannelsen af et tredje radikal osv.
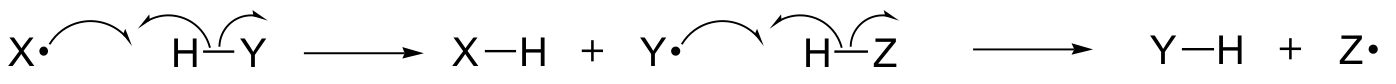
Den høje reaktivitet af frie radikale arter og deres evne til at igangsætte kædereaktioner er ofte gavnlig – vi vil i dette kapitel lære om radikale polymerisationsreaktioner, der danner nyttige materialer som plexiglas og polyproylenstof. Vi vil også lære om radikale reaktioner, der er skadelige, som f.eks. nedbrydningen af atmosfærisk ozon ved hjælp af freon og de oxidative skader, som frie radikaler forårsager på lipider og DNA i vores kroppe. Endelig vil vi se, hvordan nogle enzymer bruger bundne metaller til at katalysere høje e
Geometri og relativ stabilitet af kulstofradikaler
Som organiske kemikere er vi særligt interesserede i radikale mellemprodukter, hvor den uparrede elektron befinder sig på et kulstofatom. Eksperimentelle beviser viser, at de tre bindinger i et kulstofradikal har en trigonal planar geometri, og derfor anses kulstoffet for at være sp2-hybridiseret med den uparrede elektron, der besætter den vinkelrette, uhybridiserede 2pzorbital. Sammenlign dette billede med carbocation- og carbanion-intermedier, som begge også er trigonalplanære, men hvis 2pz-orbitaler indeholder henholdsvis nul eller to elektroner.

Tendensen i stabiliteten af kulstofradikaler er parallel med den for carbocationer (afsnit 8.4B): tertiære radikaler er f.eks. mere stabile end sekundære radikaler, efterfulgt af primære og methylradikaler. Dette burde give intuitiv mening, fordi radikaler, ligesom carbocationer, kan anses for at være elektronmanglende og således stabiliseres af de nærliggende alkylgruppers elektronafgivende virkninger. Benzyl- og allylradikaler er mere stabile end alkylradikaler på grund af resonansvirkninger – en uparret elektron kan delokaliseres over et system af konjugerede pi-bindinger. Et allylisk radikal kan f.eks. beskrives som et system af tre parallelle 2pz-orbitaler, der deler tre elektroner.
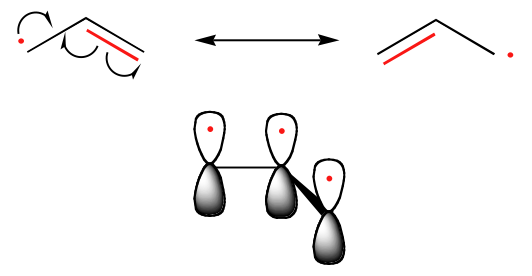
Trends i radikalstabilitet
Allyisk & Benzylisk > 3o > 2o > 1o > Methyl

I dette molekyle er den allerede omfattende resonansstabilisering yderligere forstærket af kloratomernes evne til at skærme det radikale center mod eksterne reagenser. Radikalet er på en vis måde inde i et beskyttende “bur”.
Organisk kemi med biologisk vægt af Tim Soderberg (University of Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (University of Illinois Springfield)