- Trioxyde de soufre Propriétés chimiques,utilisations,production
- Propriétés chimiques
- Propriétés physiques
- Utilisations
- Méthodes de production
- Description générale
- Air &Réactions avec l’eau
- Profil de réactivité
- Danger
- Danger pour la santé
- Danger d’incendie
- Profil de sécurité
- Exposition potentielle
- stockage
- Envoi
- Incompatibilités
- Élimination des déchets
Trioxyde de soufre Propriétés chimiques,utilisations,production
Propriétés chimiques
Le trioxyde de soufre, S03, également connu sous le nom d’anhydride sulfurique, d’aiguilles ou de polymère, existe dans un certain nombre de modifications qui diffèrent par leur espèce moléculaire et leur forme cristalline. Il existe une modification blanche, semblable à de la glace, qui fond à 16°C (61°F) et deux autres formes semblables à du bestos qui fondent à des températures plus élevées de 33 et 62°C (90 et 144°F). La forme liquide ou gazeuse incolore dégage des fumées irritantes et toxiques et bout à 45 °C (112 °F).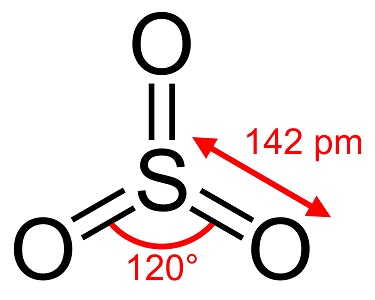
Le trioxyde de soufre est une substance très réactive, un agent oxydant puissant,et un risque d’incendie. Il réagit avec les oxydes métalliques pour former des sulfates et avec l’eau pour former de l’acide sulfurique. Le trioxyde de soufre est utilisé pour la sulfonation.
Propriétés physiques
Liquide incolore à température ambiante et à pression atmosphérique ; fumées à l’air.
Le trioxyde de soufre a tendance à se polymériser, notamment en présence de traces d’eau ou d’acide sulfurique. La vitesse de sa polymérisation, cependant, diminue fortement à mesure que l’on s’approche de son point de congélation. Le trioxyde de soufre solide (polymère) existe en trois phases polymorphes : modifications alpha, bêta et gamma.
La phase alpha est constituée d’aiguilles glacées ayant une structure réticulée polymère. Elle fond à 62,3°C et a une pression de vapeur de 73 torr à 25°C.
La phase bêta est un allotrope métastable avec des aiguilles blanches, semblables à de l’amiante, lustrées, constituées de molécules polymères, fondant à 32,5°C, et avec une pression de vapeur de 344 torr à 25°C.
La modification gamma à des températures ordinaires peut exister sous forme solide ou liquide. Sous forme solide, c’est une masse colloïdale semblable à de la glace fondant à 16,8°C. Sous forme liquide, elle a une densité de 1,9224 g/mL, bouillant à 44,8°C. Sa pression de vapeur est de 433 torr à 25°C. La phase gamma est constituée de molécules de trimères cycliques et de monomères. Lorsque le trioxyde de soufre solide fond, il se transforme en sa phase gamma qui, lors de la solidification, se transforme en modification alpha.
La température critique du SO3 est de 217,8°C ; la pression critique de 80,97 atm ; la densité critique de 0,63 g/cm3 ; la constante diélectrique du SO3 liquide à 18°C est de 3,11.
Le trioxyde de soufre se dissout dans l’eau en formant de l’acide sulfurique et en générant une grande chaleur.
Utilisations
Le trioxyde de soufre est utilisé comme intermédiaire dans la fabrication de l’acide sulfurique et de l’oléum pour la sulfonation, notamment, des colorants et des teintures, ainsi que pour la production d’acide nitrique anhydre et d’explosifs. Le trioxyde de soufre solide est commercialisé sous des noms tels que Sulphan et Triosul, et est utilisé principalement pour la sulfonation des acides organiques. Le tétrafluorure de soufre est un agent de fluoration. L’hexafluorure de soufre sert d’isolant gazeux dans les installations électriques à haute tension. Le fluorure de sulfuryle est utilisé comme insecticide et fumigène.
Sulfonation de composés organiques, notamment de détergents non ioniques, de capteurs d’énergie solaire. Il est généralement généré dans l’usine où il doit être utilisé.
Méthodes de production
Le trioxyde de soufre est produit comme intermédiaire dans la fabrication de l’acide sulfurique par le procédé de contact (Voir Acide sulfurique). Ce procédé implique l’oxydation catalytique du dioxyde de soufre en trioxyde.
Le trioxyde de soufre est préparé en laboratoire en chauffant de l’acide sulfurique fumant, en condensant ses vapeurs et en les recueillant dans un récepteur froid. Lorsque les vapeurs sont condensées en dessous de 27°C en présence de traces d’humidité, les trois phases polymorphes de SO3 sont produites. Elles peuvent être séparées par distillation fractionnée. La condensation des vapeurs au-dessus de 27°C forme la variété liquide du trioxyde de soufre gamma.
Description générale
Le trioxyde de soufre, est un solide cristallin incolore à blanc qui fume à l’air. Souvent expédié avec un inhibiteur pour empêcher la polymérisation. Le trioxyde de soufre réagit violemment avec l’eau pour former de l’acide sulfurique avec un dégagement de chaleur. Le trioxyde de soufre est corrosif pour les métaux et les tissus. Le trioxyde de soufre provoque des brûlures des yeux et de la peau. L’ingestion provoque de graves brûlures de la bouche, de l’œsophage et de l’estomac. Les vapeurs sont très toxiques par inhalation. Le trioxyde de soufre présente un risque d’incendie lorsqu’il est en contact avec des matériaux organiques tels que le bois, le coton, les panneaux de fibres, etc.
Air &Réactions avec l’eau
Se combine avec l’eau avec une force explosive, formant de l’acide sulfurique en raison de son acidité Le trioxyde de soufre carbonise la plupart des substances organiques. Lors de l’exposition à l’air, le trioxyde de soufre absorbe rapidement l’humidité, émettant des fumées blanches denses .
Profil de réactivité
La réaction du trioxyde de soufre et du difluorure d’oxygène est très vigoureuse et des explosions se produisent si la réaction est effectuée en l’absence de solvant . La réaction du trioxyde de soufre en excès avec le tétrafluoroéthylène provoque une décomposition explosive en fluorure de carbonyle et en dioxyde de soufre . La réaction de l’acide perchlorique anhydre avec le trioxyde de soufre est violente et accompagnée d’un dégagement de chaleur considérable (Pascal 16:300 1931-34). Le trioxyde de soufre liquide réagit violemment avec le chlorure de nitrile, même à 75° C. La réaction du trioxyde de soufre et de l’oxyde de plomb provoque une luminescence blanche. La combinaison d’iode, de pyridine, de trioxyde de soufre et de formamide a développé un gaz de surpression après plusieurs mois. Ceci est dû à la formation lente d’acide sulfurique, à partir de l’eau extérieure ou à la déshydratation du formamide en cyanure d’hydrogène.
Danger
Agent oxydant, risque d’incendie au contact de matériaux organiques, une augmentation explosive de la pression de vapeur se produit lors de la fusion de la forme α. L’anhydride se combine avec l’eau, formant de l’acide sulfurique et dégageant de la chaleur. Hautement toxique, fortement irritant pour les tissus.
Danger pour la santé
Le trioxyde de soufre est très toxique. C’est un irritant et un corrosif pour les membranes muqueuses. Il est toxique en cas d’inhalation ou d’ingestion. Le contact provoque des brûlures graves de la peau et des yeux.
Danger d’incendie
Risque d’incendie au contact de matières organiques. Une augmentation explosive de la pression de vapeur se produit lors de la fusion de la forme alpha. Se combine avec l’eau avec une violence explosive, formant de l’acide sulfurique. Peut enflammer d’autres matières combustibles (bois, papier, huile, etc.). Des gaz toxiques inflammables peuvent s’accumuler dans les réservoirs et les wagons-trémies. Le ruissellement vers les égouts peut créer un risque d’incendie ou d’explosion. Forme de l’acide sulfurique au contact de l’eau. Éviter l’eau et les matières organiques. Lors de l’exposition à l’air, le trioxyde de soufre absorbe l’humidité et émet des fumées blanches denses.
Profil de sécurité
Poison par inhalation. Effets systémiques humains par inhalation : toux et autres modifications pulmonaires et olfactives. Irritant corrosif pour la peau, les yeux et les muqueuses. Réaction violente avec O2F2, PbO, NClO2, HClO4, P, tétrafluoréthylène, acétonitrile, acide sulfurique, diméthylsulfoxyde, dioxane, eau, diphénylmercure, formamide, iode, pyridine, oxydes métalliques. Réagit avec la vapeur pour former des fumées corrosives et toxiques d’acide sulfurique. Lorsqu’il est chauffé jusqu’à décomposition, il émet des fumées toxiques de SO ,. Voir aussi ACIDE SULFURIQUE.
Exposition potentielle
Le trioxyde de soufre est utilisé comme agent de sulfatation et de sulfonation pour les détergents, les additifs d’huile de graissage et d’autres composés organiques ; dans les capteurs d’énergie solaire. Il est également utilisé comme intermédiaire dans la fabrication d’acide sulfurique et dans la fabrication d’explosifs.
stockage
La pression de vapeur du trioxyde de soufre s’élève rapidement avec l’augmentation de la température et, lorsque la forme α fond, l’augmentation de pression est explosive ; par conséquent, les conteneurs de transport et de stockage doivent résister à des pressions de 10 à 15 atm. Le trioxyde de soufre réagit vigoureusement et de manière fortement exothermique avec l’eau pour produire de l’acide sulfhydrique. Exposé à l’air humide, il s’enflamme et forme un brouillard d’acide sulfurique qui finit par remplir tout l’espace disponible ; il corrode également les métaux. C’est un puissant agent oxydant et, en phase liquide, il carbonise les matières organiques.
Envoi
UN1829 Trioxyde de soufre, stabilisé, Classe de danger : 8 ; Étiquettes : 8-Matière corrosive, 6.1-Danger d’inhalation toxique, Zone de danger d’inhalation B.
Incompatibilités
Combustible et corrosif. Un oxydant puissant. Réagit violemment avec l’eau, la vapeur ou l’humidité, libérant de l’acide hydrosulfurique corrosif. Des réactions violentes se produisent au contact de bases fortes ; d’acides forts, de métaux chimiquement actifs ; d’agents réducteurs ; de métaux finement divisés ; de cyanures, de nitrates, de picrates, de fulminates, de chlorates, de sulfures, de carbures, de phosphore, de difluorure de dioxygène, d’oxyde de baryum ; d’oxyde de plomb ; de diphénylmercure ; d’alcools, de chlorure de nitryle ; d’acétonitrile, de dioxane, de tétrafluoroéthylène.
Élimination des déchets
Renvoyer les bouteilles de gaz comprimé rechargeables au fournisseur. Les bouteilles non rechargeables doivent être éliminées conformément aux réglementations locales, nationales et fédérales. Laissez le gaz restant s’échapper lentement dans l’atmosphère dans une zone non confinée ou dans une hotte aspirante. Les bouteilles de type rechargeable doivent être retournées au fournisseur d’origine avec les bouchons des robinets et les bouchons de sortie fixés et les capuchons de protection des robinets en place.