Cette structure se produit lorsque deux segments (ou plus, par exemple la boucle ψ) d’une chaîne polypeptidique se chevauchent et forment une rangée de liaisons hydrogène entre eux. Cela peut se produire dans un arrangement parallèle :

Ou dans un arrangement antiparallèle :
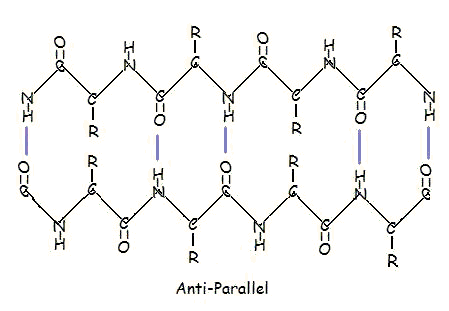
L’arrangement parallèle et antiparallèle est la conséquence directe de la directionnalité de la chaîne polypeptidique. Dans un arrangement antiparallèle, l’extrémité C-terminale d’un segment est du même côté que l’extrémité N-terminale de l’autre segment. En disposition parallèle, l’extrémité C-terminale et l’extrémité N-terminale sont du même côté pour les deux segments. Le « plissement » se produit en raison de l’alternance des plans des liaisons peptidiques entre les acides aminés ; le groupe amino et le groupe carbonyle alignés de chaque segment opposé alternent leur orientation, passant d’une orientation vers l’autre à une orientation dans des directions opposées.
L’arrangement parallèle est moins stable parce que la géométrie des molécules d’acides aminés individuelles oblige les liaisons hydrogène à se produire à un angle, ce qui les rend plus longues et donc plus faibles. Au contraire, dans l’arrangement antiparallèle, les liaisons hydrogène sont alignées directement à l’opposé les unes des autres, ce qui rend les liaisons plus fortes et plus stables.
Communément, un feuillet bêta-plissé antiparallèle se forme lorsqu’une chaîne polypeptidique inverse brusquement sa direction. Cela peut se produire en présence de deux résidus proline consécutifs, qui créent un coude dans la chaîne polypeptidique et la recourbent sur elle-même. Ce phénomène n’est pas nécessaire pour que les segments distants d’une chaîne polypeptidique forment des feuillets bêta-plissés, mais pour les segments proximaux, c’est une nécessité absolue. Pour les courtes distances, les deux segments d’un feuillet plissé bêta sont séparés par 4+2n résidus d’acides aminés, 4 étant le nombre minimum de résidus.