Vous êtes-vous déjà demandé pourquoi les bâtons lumineux (voir Fig. 1) brillent après que vous les ayez pliés ? Ou pourquoi ces étoiles en plastique brillent encore la nuit après que les lumières aient été éteintes ? Peut-être pas. Cependant, que vous vous soyez posé ces questions ou non, le texte suivant vous fournira, nous l’espérons, des réponses et des explications sur les phénomènes des bracelets lumineux, des méduses brillantes, de la lumière noire, et bien d’autres encore.

Figure 1. Bâtons lumineux.
Luminescence
En général, la lueur qui se produit dans tous les phénomènes susmentionnés est appelée luminescence. La luminescence est l’énergie libérée par une substance sous forme de lumière . On peut différencier plusieurs types de luminescence :
- Un exemple est la chimiluminescence. Au cours de certaines réactions chimiques, de l’énergie est libérée sous forme de lumière. Cela se produit après avoir plié un bâton lumineux. C’est aussi la raison de la lueur des animaux comme les méduses ou de certains micro-organismes. Dans ce cas, on parle de bioluminescence .
- Un autre type est la triboluminescence. On peut l’observer lorsqu’une enveloppe autocollante est ouverte dans le noir complet ou lorsqu’un ruban adhésif est déroulé dans une pièce sombre. Ce faisant, l’énergie mécanique est mise dans le système et sert d’activateur pour la lueur .
- Le type de luminescence le plus familier est probablement la photoluminescence. Ici, l’énergie est fournie par un rayonnement électromagnétique, par exemple par la lumière du soleil ou une lampe à ultraviolets, comme dans certaines discothèques. Cela provoque des phénomènes tels que la lueur permanente des étoiles en plastique ou l’extrême luminosité des vêtements blancs sous une lumière noire. On peut différencier la fluorescence et la phosphorescence, qui seront expliquées ci-dessous .
Qu’est-ce qu’un état électroniquement excité ?
Généralement, tous les types de luminescence sont basés sur des processus dits photo-physiques. Habituellement, les molécules elles-mêmes sont décrites comme fluorescentes. C’est le cas des colorants fluorescents comme la fluorescéine ou la curcumine . Cependant, pour expliquer les processus photo-physiques, il faut regarder de plus près à un niveau encore plus petit que le niveau moléculaire.
Les atomes de différents éléments ont un nombre différent d’électrons répartis dans plusieurs coquilles et orbitales. Les électrons sont un type de particule élémentaire. Les transitions électroniques sont responsables de la luminescence . Lorsque le système absorbe de l’énergie, les électrons sont excités et passent à un état énergétique supérieur. Avant l’excitation, dans l’état fondamental, certains des électrons se trouvent dans ce qu’on appelle l’HOMO (Highest Occupied Molecular Orbital). Après avoir atteint un état excité, ils se trouvent dans le LUMO (Lowest Unoccupied Molecular Orbital) (voir figure 2). Nous allons expliquer comment cela fonctionne exactement en utilisant la photoluminescence comme exemple spécifique.

Figure 2. Excitation électronique.
Les différents états énergétiques d’un atome ou d’une molécule sont appelés « niveaux d’énergie ». Selon la molécule et l’atome, les électrons ne peuvent occuper que des niveaux d’énergie discrets puisque l’énergie est quantifiée, ce qui signifie que l’énergie ne peut être absorbée et émise qu’en certaines quantités . La différence entre deux niveaux peut être calculée avec l’équation 1 (où E2 est le niveau d’énergie le plus élevé et E1 le plus bas).
(1) ΔE = E2-E1
Les photons, particules dont est constitué le rayonnement électromagnétique ou la lumière, doivent avoir une certaine valeur énergétique pour pouvoir exciter les électrons. L’énergie d’un photon peut être calculée avec l’équation 2, où h est la constante de Planck et ν la fréquence de la lumière.
(2) Ephoton = hν
L’énergie d’excitation nécessaire aux électrons est égale à la différence entre les niveaux d’énergie. Seule la lumière ayant une certaine énergie, et par conséquent une certaine fréquence et longueur d’onde, est capable d’exciter les électrons . En égalisant les équations 1 et 2, et à l’aide de l’équation 3 (où c représente la vitesse de la lumière), la fréquence et la longueur d’onde nécessaires peuvent être calculées (voir l’équation 4). Dans de nombreux cas, les rayons UV sont utilisés pour l’excitation.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Désactivation des états électroniquement excités
Ces états électroniquement excités sont instables. Les électrons retombent dans leur état fondamental. Dans le même temps, l’énergie d’excitation est à nouveau libérée. On distingue les processus de désintégration radiative et non radiative. La plupart du temps, la désintégration est non radiative, par exemple par relaxation vibratoire, extinction par des molécules environnantes ou conversion interne (CI). Ces processus seront expliqués en détail plus tard.
Parfois, une désintégration radiative peut se produire sous forme de fluorescence et de phosphorescence. L’énergie est émise sous forme de rayonnement électromagnétique ou de photons. La lumière émise a une longueur d’onde plus grande et une énergie plus faible que la lumière absorbée car une partie de l’énergie a déjà été libérée dans un processus de désintégration non radiative . C’est la raison pour laquelle une émission dans le spectre visible peut être obtenue par excitation avec des rayons UV non visibles. Ce décalage vers une plus grande longueur d’onde est appelé décalage de Stokes .
Comparaison : Fluorescence vs Phosphorescence
La fluorescence et la phosphorescence sont toutes deux des émissions spontanées de rayonnement électromagnétique. La différence est que la lueur de la fluorescence s’arrête juste après l’extinction de la source de rayonnement excitateur, alors que pour la phosphorescence, une rémanence avec des durées de fractions de seconde jusqu’à des heures peut se produire .
Pour comparer les processus photo-physiques derrière les deux phénomènes, il y a quelques faits sur les électrons qui sont utiles pour la compréhension : Les électrons sont des particules qui ont un soi-disant spin et un nombre quantique de spin. Celui-ci peut avoir deux valeurs différentes, à savoir +1/2 ou -1/2 . Ce nombre est une propriété que nous ne pouvons pas imaginer ou décrire facilement. On le compare souvent à une toupie qui tourne dans le sens des aiguilles d’une montre ou dans le sens inverse. Toutefois, cette description n’est ni mathématiquement ni physiquement tout à fait correcte. Deux électrons dans une seule orbitale d’un atome ont un spin antiparallèle, qui est noté (↓) .
Fluorescence
Dans le diagramme de Jablonski pour la fluorescence (voir figure 3), l’état de spin singulet S0 est l’état fondamental des électrons, et S1 et S2 sont des états excités singulet (les états ne sont utilisés qu’à titre d’exemple dans ce texte et ne s’appliquent pas nécessairement à certains atomes, molécules, etc.) Au sein de ces états, il existe plusieurs niveaux d’énergie. Plus le niveau est élevé, plus l’électron possède d’énergie lorsqu’il se trouve dans ce niveau. Dans le cas des états singlets, les électrons ont des spins antiparallèles.

Figure 3. Diagramme de Jablonski pour la fluorescence.
Les électrons sont élevés de l’état fondamental S0, par exemple, à un niveau d’énergie du deuxième état excité S2, lorsqu’ils sont excités par un rayonnement électromagnétique. Après l’arrêt de l’excitation, les électrons ne restent dans cet état excité que pendant une courte période de temps (environ 10-15 s), puis commencent immédiatement à redescendre dans l’état fondamental . Ce faisant, l’énergie peut initialement être libérée dans l’environnement par relaxation vibratoire. Cela signifie que l’énergie thermique est libérée par le mouvement de l’atome ou de la molécule jusqu’à ce que le niveau le plus bas du deuxième état excité soit atteint.
L’écart plus important entre le deuxième et le premier état excité est surmonté par une conversion interne. Cela décrit une transition électronique entre deux états alors que le spin des électrons est maintenu. Maintenant, les électrons peuvent se relaxer davantage en raison d’une plus grande relaxation vibratoire jusqu’à ce qu’ils atteignent le niveau d’énergie le plus bas de l’état S1.
Théoriquement, les électrons pourraient se relaxer encore davantage de manière non radiative jusqu’à ce qu’ils finissent par atteindre à nouveau l’état fondamental. Cependant, il peut arriver que la dernière quantité d’énergie soit trop importante pour être libérée dans l’environnement car les molécules environnantes ne peuvent pas absorber une telle quantité d’énergie. Il y a alors fluorescence, ce qui entraîne l’émission de photons d’une certaine longueur d’onde. L’émission ne dure que jusqu’à ce que les électrons reviennent à l’état fondamental. Puisque pendant toutes ces transitions, le spin de l’électron reste le même, elles sont décrites comme étant autorisées par le spin .
Phosphorescence
Pour la phosphorescence, les choses sont un peu différentes (voir figure 4). Il y a à nouveau un état fondamental S0 et les deux états excités, S1 et S2. En outre, il existe un état triplet T1 excité qui se situe énergétiquement entre les états S0 et S1. Les électrons ont à nouveau des spins antiparallèles dans l’état fondamental.
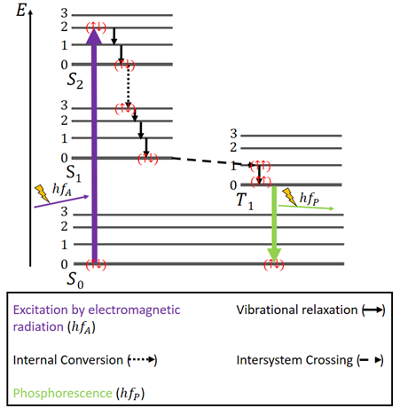
Figure 4. Diagramme de Jablonski pour la phosphorescence.
L’excitation se produit de la même manière que pour la fluorescence, à savoir par le biais d’un rayonnement électromagnétique. La libération d’énergie par relaxation vibratoire et conversion interne tout en conservant le même spin est ici aussi la même, mais seulement jusqu’à ce que l’état S1 soit atteint.
A côté des états singulet, il existe un état triplet et ce qu’on appelle le croisement intersystème (ISC) peut se produire puisque l’état T1 est énergétiquement plus favorable que l’état S1. Ce croisement, comme la conversion interne, est une transition électronique entre deux états excités. Mais contrairement à la conversion interne, l’ISC est associé à une inversion de spin du singulet au triplet. Les électrons dans l’état triplet ont des spins parallèles, ce qui est noté comme () . Ce processus ISC est décrit comme « interdit de spin ». Il n’est pas complètement impossible – en raison d’un phénomène appelé « couplage spin-orbite » – mais il est plutôt improbable .
Dans l’état T1, la désintégration non radiative est également possible. Cependant, une transition entre le niveau d’énergie le plus bas de l’état triplet et l’état S0 n’est pas facilement possible, parce que cette transition est interdite de spin, aussi. Néanmoins, elle peut tout de même se produire avec une petite possibilité. Elle provoque une émission assez faible de photons, car le spin de l’électron doit à nouveau être inversé. L’énergie est piégée dans cet état pendant un certain temps et ne peut être libérée que lentement. Après que toute l’énergie a été libérée, les électrons sont de nouveau dans l’état fondamental .
Conclusion
Les processus de spin autorisé et interdit servent d’explications pour une lueur de fluorescence qui cesse immédiatement et pour la rémanence de la phosphorescence. La phosphorescence ne se produit généralement qu’avec des molécules « plus lourdes », car le spin doit être inversé à l’aide d’un couplage spin-orbite. L’émission d’un rayonnement électromagnétique et sa longueur d’onde dépendent de la quantité d’énergie qui peut être libérée au préalable par désintégration non radiative. Cela dépend également des propriétés de ce qu’on appelle des quenchers qui sont des molécules environnantes et qui sont capables d’absorber de plus grandes quantités d’énergie.
Tous les processus qui peuvent conduire à une inhibition des désintégrations radiatives peuvent provoquer une extinction de la fluorescence. Les exemples sont les processus de désintégration non radiative, mais aussi la destruction de la molécule fluorescente . L’efficacité quantique décrit l’efficacité du processus et est définie comme le rapport entre les photons absorbés et émis . Cette propriété est différente pour chaque substance.
Même si ce texte se concentre sur la photoluminescence, les processus photo-physiques sont les mêmes pour tous les types de luminescence .
Applications
En plus des produits comme les bâtons lumineux, la fluorescence et la phosphorescence sont utilisées de nombreuses autres façons. D’autres exemples sont les poteaux de guidage menant à une sortie de secours qui ne nécessitent aucune alimentation électrique mais qui brillent la nuit en raison de la phosphorescence. Même les plantes peuvent être rendues fluorescentes : Les épinards peuvent être modifiés à l’aide des nanotechnologies de manière à pouvoir détecter les traces de substances explosives dans les eaux souterraines. Les feuilles contiennent des nanotubes de carbone auxquels les nitroaromatiques peuvent se lier. S’ils le font, un signal fluorescent est libéré par la plante et peut être détecté avec des caméras infrarouges .
La vidéo démontre différents types de luminescence. À gauche, elle montre la fluorescence du colorant curcumine, qui est contenu dans l’épice curcuma, sous la lumière UV . La curcumine est dissoute dans de l’alcool pour rendre la fluorescence visible.
L’araignée en plastique et le composé dans le petit tube sont des exemples de phosphorescence. L’aluminate de strontium, contenu dans le tube, est initialement excité par les rayons UV et finit par émettre une lumière verte. La cause en est un dopage avec des éléments comme l’europium, qui rend le composé utilisable comme pigment luminescent .
Plier le bâton lumineux (à droite) initie une réaction chimique entre le peroxyde d’hydrogène et un colorant et l’oxalate de phényle. La chimiluminescence peut être observée.
Vidéo 1. Comparaison de la fluorescence, de la phosphorescence et de la chimiluminescence.
K. Arnold et al., Chemie Oberstufe (en allemand), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN : 978-3-06-011179-4
Lexikon der Physik : Lumineszenz (en allemand), spektrum.de. (consulté le 25 janvier 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (en allemand), chemieunterricht.de 2010. (consulté le 25 janvier 2017)
Lexikon der Physik : Photophysikalische Prozesse (en allemand), spektrum.de. (consulté le 27 janvier 2017)
D. Wiechoczek, Chemie mit Curry (en allemand), chemieunterricht.de 2015. (consulté le 27 janvier 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (en allemand), Wiley-VCH, Weinheim, 2008, 853ff, 921ff. ISBN : 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (in German), chemie.de. (accessed January 27, 2017)
Relation de fréquence de Bohr (in French), chemgapedia.fr. (accessed January 25, 2017)
Université Technique d’Ilmenau, Stage de Chimie Physique II : Chimie Physique/Micro-réaction, Expérience Fluorescence-Quenching (in French), tu-ilmenau.de. (accessed January 27, 2017)
Déplacement de Stokes (in French), chemie.de. (accessed January 25, 2017)
Spin des électrons (in German), chemie.de. (accessed January 27, 2017)
Rendement quantique (in French), chemie.de. (accessed January 27, 2017)
Les épinards détectent les explosifs dans les eaux souterraines (in French), Spiegel Online, November 1, 2016. (accessed January 27, 2017)
D. Weiß, Phosphorescence (in French), chemie.uni-jena.de. (consulté le 27 janvier 2017)
 Kim Dreier est une élève du Marianne-Weber-Gymnasium (école secondaire) à Lemgo, en Allemagne.
Kim Dreier est une élève du Marianne-Weber-Gymnasium (école secondaire) à Lemgo, en Allemagne.