Propriétés générales des sels
Certaines des propriétés caractéristiques des sels sont :
- Points de fusion et d’ébullition : Les sels sont principalement des solides qui fondent aussi bien qu’ils bouillent à des températures élevées.
- Solubilité dans l’eau : Les sels sont généralement solubles dans l’eau. Par exemple, le chlorure de sodium, le sulfate de potassium, le nitrate d’aluminium, le carbonate d’ammonium, etc, sont des sels solubles alors que le chlorure d’argent, le chlorure de plomb, le carbonate de cuivre, etc, sont insolubles dans l’eau.
- Eau de cristallisation : Généralement, les sels se trouvent sous forme de cristaux dans lesquels sont présentes des molécules d’eau. Cette eau est appelée eau de cristallisation et ces sels sont appelés sels hydratés.
Par exemple, le cristal de sulfate de cuivre possède cinq molécules d’eau pour chaque molécule de sulfate de cuivre. Cela s’écrit CuSO4.5H2O. Cette eau de cristallisation donne au cristal sa forme. Elle donne également de la couleur à certains cristaux. En chauffant, les sels hydratés perdent leur eau de cristallisation et, par conséquent, les cristaux perdent leur forme et leur couleur et se transforment en une substance poudreuse.
Les sels hydratés qui ont perdu leur eau de cristallisation sont appelés sels anhydres.
Lorsque le sulfate de cuivre hydraté est chauffé, il dégage des molécules d’eau pour former du sulfate de cuivre anhydre en poudre blanche. En ajoutant de l’eau, cette substance peut se reconvertir à nouveau en une solution de sulfate de cuivre hydraté.
On demande aussi
- Classification des sels
- Utilisations des différents sels dans la vie quotidienne
- Préparation des sels
- Décrire la préparation des sels solubles et insolubles
- Qualitative. Analyse des sels
- Action de la chaleur sur les sels
- Test des cations et des anions dans les solutions aqueuses
- Construction des équations ioniques par la méthode de variation continue
- Qu’est-ce que la stœchiométrie et pourquoi est-elle utilisée en chimie ?
Propriétés générales des sels :
1. Réaction avec un acide : Lorsqu’un sel réagit avec un acide, un autre sel et un autre acide sont formés. Par exemple, lorsque le chlorure de sodium est chauffé avec de l’acide sulfurique, de l’hydrogénosulfate de sodium (à basse température) puis du sulfate de sodium (à haute température) sont produits et du gaz de chlorure d’hydrogène est dégagé.
2. Réaction avec une base : Un sel réagit avec une base pour produire un autre sel et une autre base.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Réaction avec un métal : Parfois, une solution saline peut réagir avec un métal. Par exemple, lorsqu’un clou en fer est plongé dans une solution aqueuse de sulfate de cuivre, le cuivre se dépose à la surface du clou et le sulfate ferreux formé reste dans la solution.
CuSO4 + Fe → FeSO4 + Cu
Cette réaction montre que le fer est plus réactif que le cuivre.
Donc, un métal plus réactif peut déplacer un métal moins réactif d’une solution de son sel.
4. Comportement des sels vis-à-vis de l’eau :
Lorsqu’un sel est dissous dans l’eau, la solution peut être neutre, acide ou alcaline. Cela dépend de la nature du sel utilisé.
(i) Un sel normal dérivé d’un acide fort et d’une base forte donne une solution neutre. Par exemple, les solutions aqueuses de NaCl et de K2SO4 sont neutres à la tournesol.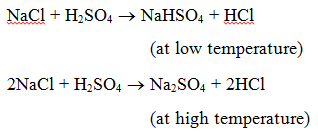
(ii) Un sel normal dérivé d’un acide faible et d’une base forte donne une solution alcaline. Par exemple, les solutions aqueuses à la fois du carbonate de sodium (Na2CO3) et de l’acétate de sodium (CH3COONa) sont alcalines.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Un sel dérivé d’un acide fort et d’une base faible donne une solution acide. Par exemple, le chlorure d’aluminium (AlCl3) et le chlorure d’ammonium (NH4Cl) donnent tous deux des solutions aqueuses acides.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Les solutions de sels acides sont acides au litmus, c’est-à-dire que ces solutions rendent rouge le papier tournesol bleu. Par exemple, une solution d’hydrogénosulfate de sodium (NaHSO4) rend le papier tournesol bleu rouge.
La solution d’hydrogénocarbonate de sodium (NaHCO3), cependant, est légèrement alcaline.