La section précédente montre comment différents éléments peuvent exister seuls ou se combiner avec d’autres éléments pour former des composés. Cette section s’appuie sur ces idées en examinant les réactions chimiques plus en détail. Elle montre également comment la sténographie chimique peut être étendue à la description des réactions chimiques.
Premièrement, considérons certaines des molécules décrites précédemment : l’eau, le méthane, le dioxyde de carbone et l’ammoniac.
Question 26
Quelles sont les formules de chacune de ces quatre molécules ?
Réponse
Les formules sont respectivement H2O, CH4, CO2 et NH3.
Bien que vous n’ayez pas besoin de vous souvenir des formules chimiques des composés présentés dans ce cours, vous trouverez probablement utile d’en mémoriser quelques-unes, comme celles des quatre molécules ci-dessus, plus celles des molécules d’hydrogène (H2), d’azote (N2) et d’oxygène (O2). Cela vous aidera à lire et à écrire ces formules chimiques sans avoir à vous référer continuellement aux sections précédentes.
Vous allez maintenant examiner les réactions impliquant les éléments hydrogène, carbone et oxygène et les composés méthane, eau et dioxyde de carbone.
L’hydrogène réagira avec l’oxygène lorsqu’il est enflammé (il est assez explosif) pour former de l’eau. Pour écrire une telle réaction en termes d’équation chimique, on met à gauche les substances qui subissent la réaction et à droite les substances qui sont produites par la réaction. Les réactifs à gauche sont reliés aux produits à droite par une flèche.
L’équation peut être écrite sous la forme d’une équation verbale ‘l’hydrogène et l’oxygène font de l’eau’ ou, en utilisant un peu de sténographie chimique, elle peut être écrite comme:

où la flèche signifie ‘va à’.
Maintenant, essayez d’utiliser la sténographie chimique pour écrire l’équation. En substituant les symboles dans le mot équation, on obtient :

L’équation montre que les réactifs à gauche de la flèche sont convertis en produit à droite. Cependant, il y a quelque chose qui ne va pas dans cette équation. Vous pouvez voir ce qui ne va pas en regardant la figure 21 où les réactifs et les produits sont représentés sous forme de diagramme.
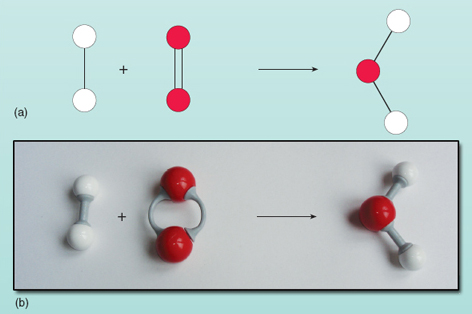
Compter le nombre d’atomes de chaque côté de l’équation montre qu’il y a deux atomes d’oxygène à gauche contre un à droite. Le nombre d’atomes d’oxygène des deux côtés de l’équation doit être égal – ils ne peuvent pas apparaître et disparaître par magie au cours d’une réaction. Il n’est pas possible de modifier la composition de la molécule d’eau à droite de l’équation car la molécule d’eau existe sous la forme d’un groupe de deux atomes d’hydrogène et d’un atome d’oxygène, tous liés ensemble. Chaque molécule d’oxygène fournit deux atomes d’oxygène et formera donc toujours deux molécules d’eau, à condition qu’il y ait deux molécules d’hydrogène (chacune étant une unité de deux atomes) pour réagir avec elle. Ainsi, deux molécules d’hydrogène et une molécule d’oxygène sont nécessaires pour fabriquer deux molécules d’eau. La réaction s’exprime précisément par :

Il y a maintenant le même nombre de chaque type d’atome des deux côtés de l’équation : l’équation chimique est équilibrée, on peut donc maintenant remplacer la flèche par un signe égal.
Un dernier toilettage pour éviter de répéter les molécules d’hydrogène à gauche de l’équation et les molécules d’eau à droite consiste à les représenter par 2H2 plutôt que H2 + H2. Ainsi, l’équation chimique équilibrée devient :

Ceci est représenté schématiquement dans la figure 22.

Les équations chimiques montrent de manière très concise non seulement quels atomes et molécules réagissent ensemble pour former les produits, mais aussi combien de chaque sorte d’atome et de molécule sont impliqués. Il est important de se rappeler que le chiffre précédant une molécule signifie le nombre de cette molécule particulière. Par exemple, 3H2O signifie trois molécules d’eau, ce qui donne un total de six atomes d’hydrogène et de trois atomes d’oxygène.
Les équations chimiques doivent s’équilibrer ; le nombre d’atomes de chaque type d’élément des deux côtés de l’équation doit être égal.
Vous savez maintenant comment « lire » ou interpréter une équation chimique – et comment elle représente un processus chimique. Cependant, les chimistes sont également très habiles à écrire des équations chimiques comme une forme de sténographie pour décrire divers processus ou réactions chimiques. L’écriture d’équations chimiques est comme l’écriture d’une langue étrangère : il faut de la pratique pour la maîtriser. Cependant, tous les scientifiques en herbe doivent commencer quelque part et la section ci-dessous vous montre comment le faire en utilisant une réaction chimique très familière. Si vous souhaitez vérifier si vous avez besoin d’étudier cette section, essayez d’abord la question 20.