Luke Spooner著
- 1 Function
- 2 Structure
- 3 機能
- 4 臨床応用
- 5 アスパラギン酸アミノトランスフェラーゼの立体構造
機能
Aspartate Aminotransferase (AAT), グルタミン酸アスパラギン酸トランスアミナーゼ、グルタミン酸オキサロ酢酸トランスアミナーゼ、プレフェン酸アミノトランスフェラーゼ、トランスアミナーゼAとも呼ばれ、クラスIピリドキサールリン酸依存性アミノトランスフェラーゼファミリーに属する酵素の一つです。 GOT1という遺伝子によってコードされている。 アミノ酸と糖質の代謝、尿素生成、ミトコンドリアと葉緑体への還元当量の移動において重要な役割を担っている。 原核細胞内では細胞質のみに存在するが、真核細胞内では細胞質、ミトコンドリア、葉緑体のアイソザイムが存在する。 プレファネートからアロゲン酸への転移には、二機能性アスパラギン酸アミノトランスフェラーゼ(BAAT)が必要である。
人体では、脳、骨格筋、肝臓、膵臓、赤血球、腎臓で生産されている。 そのため、主に肝臓に存在する類似の酵素であるアラニントランスアミナーゼ(ALT)とは区別されます。 体内のAATのレベルは、組織の病気や損傷のマーカーとして使用されることがあります。 同様に、AATとALTのレベルは、組織の損傷が主に肝臓内で見られるかどうかを特定するために比較することができます。
構造
は、(アルファヘリックス、ベータストランド、ループ、ターン)を含む。 アスパラギン酸アミノトランスフェラーゼの非対称ユニットで、小ドメインと大ドメイン、PLP補酵素(1b4x)が強調されている。 各サブユニットには、同等の活性部位がある。 サブユニットは2つの部位で結合している:それぞれのラージドメインの間と、N末端残基ともう一方のサブユニットのラージドメインの間である。 ASTのこの構造は、大腸菌からヒトに至るまで、生物によって微細に異なっている。 また、活性部位の構造は25%の配列相同性で高度に保存されている。
ホモダイマーの各サブユニットは、さらに小ドメインと大ドメインに分けられる。 小ドメインはN末端からPro 48残基までとMet 326残基からC末端までのアミノ酸から構成され、大ドメインはN末端からC末端までのアミノ酸から構成される。 6601>
大ドメインにはAATの活性部位があり、これに対応するためにコアには多くのα/β超2次構造が存在する。 これは、2つのα-ヘリックスと2つのβ-ストランドから形成されるスモールサブユニットのコアと対照的である。 多細胞生物では、325番目の残基のところにキンクがあり、これが小ドメインのヒンジとして働き、酵素に阻害剤が結合したときに起こる構造変化を可能にしている。
上述したように、ASTの活性部位はサブユニットの大きなドメインに位置している。 この活性部位には、内部アルジミンとして知られるアミノ酸残基Lys 258があり、補酵素であるピリドキサール5′-リン酸()と結合し、シッフ塩基と呼ばれるものを形成している。 アミノ酸の基質が加わると、PLPとアミノ酸の間に新たなシッフ塩基が形成される。
機能
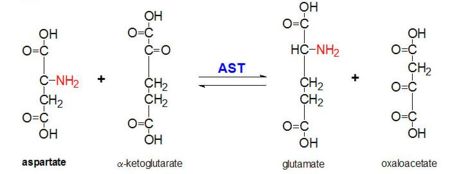
図2.PLPの機能 アスパラギン酸アミノトランスフェラーゼ
AAT はL-アスパラギン酸からα-ケトグルタル酸へのα-アミノ基の可逆的トランスアミネーションを触媒して、オキサロ酢酸とグルタミン酸を生成する。 この反応性は大腸菌では高等真核生物に比べて低く、より広い基質特異性を持っている。 しかし、反応は同じように行われる。 アミノ酸の基質が導入されると、その基質とPLP補酵素の間に新たなシッフ塩基が形成される。 これにより、アミノ酸は水素を失ってキノイド中間体を形成し、再反応が起こってケチミンが生成される。 次に、この構造が加水分解され、α-ケト酸とピリドキサミンリン酸が生成される。 2-メチルアスパラギン酸は、アスパラギン酸ではなく、PLP補酵素とスキーフ塩基を形成するときにAATの阻害剤として作用する。 その結果、αタンパク質が除去される前の段階でプロセスが停止する。
この反応は、生物の恒常性を維持するために不可欠である。 この転移の結果形成される4種類の分子(オキサロ酢酸、α-ケトグルタル酸、アスパラギン酸、L-グルタミン酸)は、多くの代謝プロセスにとって重要な役割を担っています。 オキサロ酢酸とα-ケトグルタル酸はクレブスサイクルで重要な役割を果たし、様々な形態のアスパラギン酸は尿素サイクルで重要な分子で、糖新生に関与し、グルタミン酸は記憶に関連する代謝経路で重要な分子である
臨床応用
体内のAATレベルは組織の損傷や病気を示唆する。 通常、AATは血液中に微量に存在しますが、上記の臓器がダメージを受けると、AATが血液中に放出されます。 放出される量は、受けたダメージの程度に比例する。 AATの濃度は、最初の組織の劣化から6時間以内に大幅に上昇し、最大で4日間上昇したままになることが分かっています。 AATの値を他の酵素の値と比較することにより、医師は体内のどの部位に損傷が生じたかを判断することができる。 ALTとの比較は、肝硬変や肝炎などの肝障害の特定に特に有用であることが証明されています。 正常な状態では、男性のAAT値は6~34 IU/L、女性は8~40 IU/Lです。
aspartate aminotransferaseの立体構造
Aspartate aminotransferase 3D structures