- Key Points
- Introduction
- Méthodes
- Résultats
- Echantillon et expérience des participants
- Dommages globaux moyens
- Différence entre les évaluateurs des hôpitaux de soins aigus et de réadaptation?
- Comparaison avec la dernière analyse européenne
- Contrôle de plausibilité et test de sensibilité
- Discussion
- Conclusion
- Data Availability Statement
- Ethics Statement
- Contributions des auteurs
- Conflit d’intérêt
- Remerciements
- Matériel supplémentaire
Key Points
Les drogues illicites telles que la méthamphétamine, l’héroïne et la cocaïne, mais aussi l’alcool ont été jugées particulièrement nocives.
Les médicaments prescrits, y compris les opioïdes (contrairement aux États-Unis, au Canada et à l’Australie) et les analgésiques non opioïdes, y compris les gabapentinoïdes, ont été jugés moins nocifs.
Les lois actuelles sont quelque peu incongrues avec ces classements des dommages.
Introduction
L’abus de substances psychoactives addictives se caractérise par des conséquences sanitaires et sociales négatives non seulement pour l’utilisateur, mais aussi pour les non-utilisateurs dans la communauté ou la société (1, 2). Le DSM-5 a défini diverses conditions spécifiques de dépendance et d’addiction liées aux substances (3), et le codage CIM-10 reflète des troubles mentaux et comportementaux distincts liés à l’alcool, au tabac, aux opiacés, à la cocaïne, aux stimulants, aux hallucinogènes, aux sédatifs et aux hypnotiques, au cannabis et aux cannabinoïdes, et aux solvants volatils (4).
Au cours des 15 dernières années, le potentiel relatif de nuisance sanitaire et sociale de diverses substances addictives a été déterminé en Angleterre (5), aux Pays-Bas (6), en Écosse (7), en France (8) et plus récemment en Australie (9) par des experts médicaux et non médicaux en addictologie. La nocivité globale moyenne de diverses substances est généralement rapportée dans des classements relatifs, basés sur des analyses multi-décisions (5, 9) ou reposant sur des évaluations « ad-hoc » (6-8) utilisant des dimensions sanitaires et sociales validées (5). Ces classements ne correspondent pas nécessairement aux priorités des législateurs et des forces de l’ordre en termes de réglementation et de contrôle relatifs des substances, l’alcool étant un excellent exemple de dissonance entre les méfaits globaux et les efforts de contrôle (5-9). Nutt et al. ont été les premiers à démontrer cette incongruité (5).
En 2014, un groupe de 40 experts médicaux et non médicaux en addictions de 21 pays de l’UE est arrivé à la même conclusion (10). Cette enquête portait sur 20 substances (10). Dans l’intervalle, comme dans d’autres pays occidentaux, on a assisté à une évolution des tendances en matière d’abus de substances ainsi que des conditions-cadres politiques en Allemagne, notamment
– Augmentation de l’abus de méthamphétamine principalement dans les régions limitrophes de la République tchèque (11-13).
– Apparition croissante de nouvelles substances psychoactives (NPS), en particulier une pléthore de cannabinoïdes synthétiques et de stimulants (principalement des cathinones) (12-14).
– Augmentation des surdoses mortelles à l’héroïne/morphine, aux analgésiques contenant des opioïdes et aux analgésiques non opioïdes, aux opioïdes synthétiques, aux narcotiques, à l’amphétamine, aux dérivés de l’amphétamine, à la méthamphétamine et aux NPS, accompagnée d’une diminution des décès par surdose grâce aux médicaments de traitement de la dépendance aux opioïdes tels que la méthadone et la buprénorphine (11, 15).
– Disponibilité croissante de produits à base de cannabis très puissants présentant un risque accru de psychose et de dépendance (11, 13, 16, 17).
– Légalisation de la marijuana médicinale et des cannabinoïdes sur prescription médicale (18).
Compte tenu de ces évolutions, nous avons cherché à mettre à jour l’évaluation des méfaits sanitaires et sociaux des substances couramment utilisées à mauvais escient en Allemagne et ailleurs, ainsi que des substances moins fréquemment consommées dans notre pays, mais déjà émergentes (11, 12). Dans ce contexte, les cannabinoïdes synthétiques (14) ont été inclus pour la première fois dans le classement des méfaits. Nous avons également inclus des études d’indexation des classements des méfaits du propofol, un anesthésique intraveineux (19), et de certains analgésiques non opioïdes (ANO), c’est-à-dire les gabapentinoïdes, les anti-inflammatoires non stéroïdiens (AINS), la flupirtine et les triptans (20-24). Nous avons décidé d’inclure les AINS ainsi que les analgésiques opioïdes dans nos évaluations car la gabapentine et la prégabaline (gabapentinoïdes) ont récemment fait l’objet d’une attention particulière de la part de la médecine des dépendances. Au cours de la dernière décennie, plusieurs bases de données de pharmacovigilance, des études de population et des rapports de cas ont mis en garde contre leurs risques d’abus et leur contribution présumée à des surdoses mortelles, notamment en association avec des opioïdes (22, 23). Bien que les AINS soient généralement considérés comme ne créant pas d’accoutumance, de récents rapports de cas (25, 26), des données épidémiologiques (27, 28) et cliniques (24) soulèvent certaines inquiétudes quant à la sécurité de cette vision traditionnelle. D’autres APN ont également montré une responsabilité potentielle en matière d’abus et de dépendance, par exemple la flurpirtine (21) ou les triptans (20). Par conséquent, il nous a semblé prudent d’inclure également les AAN susmentionnés pour la première fois dans une étude de ce type. Cette étude est la première de son genre à inclure des classements comparatifs des dommages de plusieurs nouvelles substances abusées, à la fois licites/prescrites et illicites.
Méthodes
Cette étude transversale par questionnaire comprenait deux étapes consécutives (enquête 1 et enquête 2, voir ci-dessous), dans lesquelles des questionnaires quantitatifs ont été distribués sous forme écrite parmi les experts allemands en médecine des addictions. Ces experts ont été recrutés lors de congrès et de conférences allemands sur les addictions. En outre, les questionnaires ont été envoyés par courrier électronique à 40 directeurs de centres allemands de traitement des toxicomanies, à qui il a été demandé de les distribuer dans leur zone d’influence à d’autres experts en toxicomanie. Seuls les questionnaires remplis par des médecins (i) spécialistes, c’est-à-dire possédant une expertise supplémentaire dans au moins une spécialité médicale et (ii) travaillant depuis plus de 5 ans dans des hôpitaux de soins tertiaires dans le domaine du traitement des troubles liés à la consommation de substances (TLC) ont été inclus dans l’analyse. L’identité des experts est restée anonyme à l’exception des informations concernant leur âge, leur sexe, leurs spécialités, leurs années d’expérience professionnelle, leurs années de travail dans le domaine des soins tertiaires des troubles liés à la consommation de substances psychoactives et le principal centre d’intérêt de leur travail professionnel (hôpital de soins aigus ou de réadaptation) (tableau 1).
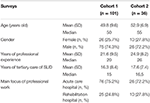
Tableau 1. Caractéristiques des participants.
La première enquête a été menée de mars 2016 à septembre 2017 et a évalué le préjudice moyen de 33 substances dans dans 5 dimensions (préjudice physique pour les utilisateurs, préjudice psychologique pour les utilisateurs, préjudice social pour les utilisateurs, préjudice physique et psychologique pour les autres, et préjudice social pour les autres). Comme le montre la figure supplémentaire 1, ces dimensions ont été définies par 16 critères, qui ont été validés dans plusieurs études de ce type (5, 9, 10) (voir la section Matériaux supplémentaires – Méthodes). Le préjudice global pour les utilisateurs et le préjudice global pour autrui comprenaient respectivement 3 dimensions (physique, psychologique, sociale) et 2 dimensions (physique & psychologique, sociale) (pour plus de détails, voir la figure supplémentaire 1). Les évaluations ont été réalisées à l’aide d’échelles en 5 points (de « pas nuisible » à « extrêmement nuisible »).
Le questionnaire a été retourné par 122 médecins et parmi ceux-ci 101 ont été évalués car 21 experts ne répondaient pas aux critères d’inclusion. Les médecins ont été autorisés à décider eux-mêmes d’évaluer une substance ou non, et il leur a été demandé d’estimer leur expérience professionnelle (« aucune/peu », « modérée » ou « beaucoup ») avec chaque substance qu’ils avaient évaluée. Ces informations étaient nécessaires pour évaluer la validité des évaluations et pour vérifier les critères d’exclusion définis, c’est-à-dire qu’une substance avec <60% d’évaluations ou plus de 60% d’évaluations « pas/peu d’expérience » était exclue de l’analyse. Par conséquent, les substances ayahuasca, khat et kratom ont dû être exclues de l’évaluation des méfaits (figures supplémentaires 2 et 3).
La deuxième enquête (pondération des dimensions pour déterminer le préjudice global dans la figure 1) a été menée de septembre 2017 à mai 2018 par la cohorte 2, qui a été recrutée uniquement à partir des courriels adressés aux 40 responsables de centres de traitement des toxicomanies allemands susmentionnés. Cette enquête de suivi a été administrée ultérieurement car la première enquête était assez complète, et il a été jugé que la combinaison des deux enquêtes risquait de surcharger les répondants de la cohorte 1, ce qui a réduit le quota de retour. La seconde enquête demandait aux participants d’estimer le poids relatif (en tant que proportion entre 0 et 1) de chacune des 5 dimensions utilisées dans la première enquête pour la constitution du préjudice global des substances psychotropes. Les 36 questionnaires retournés ont tous été inclus. Nous avons utilisé le poids relatif moyen donné par les 36 experts à chaque dimension pour calculer la nocivité globale de chaque substance (Figure 1). D’autres détails sur le calcul de la nocivité globale des 30 substances restantes et les analyses de données connexes, y compris la comparaison avec le précédent classement de l’UE (figure 3), sont présentés dans les matériaux supplémentaires.
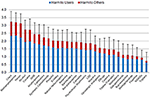
Figure 1. Nocivité globale moyenne de 30 substances (valeurs moyennes et écarts types) telle qu’évaluée par la cohorte 1 sur une échelle de 0 (« non nocif ») à 4 (« extrêmement nocif »), présentée comme nocive pour les utilisateurs et nocive pour les autres. La contribution relative des 5 dimensions (figure supplémentaire 1, tableau supplémentaire 1) avait été pondérée par la cohorte 2.
La validation des classements a été effectuée tout d’abord en évaluant l’ampleur de la variabilité entre la cote de nocivité globale et l’une des cinq dimensions composantes. Une différence entre la note globale de préjudice et l’une des 5 notes distinctes dans les dimensions ≥8 rangs a été considérée comme significative et nécessite une explication de plausibilité (tableau 2). Un test de validation/sensibilité supplémentaire a été effectué en remplaçant les pondérations moyennes dérivées de notre enquête par les pondérations consensuelles de l’étude précédente de l’UE (tableau supplémentaire 1) et en comparant les classements des substances résultants de la figure 9 supplémentaire avec ceux de la figure 1 (tableau supplémentaire 2).
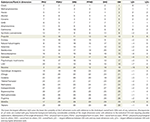
Tableau 2. Contrôle de plausibilité des classements globaux des préjudices.
Résultats
Echantillon et expérience des participants
Les médecins spécialistes avaient travaillé pendant une médiane de 15 ans (cohorte 1) et 16,5 ans (cohorte 2) dans les soins tertiaires des patients atteints de SUD. Environ trois participants sur quatre travaillaient dans des hôpitaux de soins actifs, les autres dans des cliniques de réadaptation (tableau 1).
Dommages globaux moyens
Les évaluations des experts dans les 5 dimensions distinctes sont présentées dans les (figures supplémentaires 4-8). En ce qui concerne les dommages globaux, les drogues traditionnelles, c’est-à-dire la cocaïne (y compris le crack), la méthamphétamine, l’héroïne et l’alcool, ont été classées comme étant les plus dangereuses. Les NPS, c’est-à-dire les cathinones et les cannabinoïdes synthétiques, occupaient des positions subalternes dans le groupe des drogues les plus nocives. La kétamine, les benzodiazépines, le cannabis, les champignons psychotropes, le LSD, la nicotine et les analgésiques opioïdes se situaient au milieu du classement. La méthadone et la buprénorphine (toutes deux privilégiées en Allemagne pour le traitement d’entretien de la dépendance aux opiacés) se situent dans les fourchettes inférieures, tandis que le méthylphénidate (le médicament privilégié en Allemagne pour le traitement du TDAH) et les NOA se situent dans les fourchettes inférieures du classement des dommages. Parmi les AAN, la gabapentine et la prégabaline (gabapentinoïdes) étaient considérées comme plus nocives que la flupirtine, les AINS et les triptans (figure 1).
Différence entre les évaluateurs des hôpitaux de soins aigus et de réadaptation?
Les évaluations des spécialistes des hôpitaux de soins aigus et de réadaptation étaient très similaires, comme le montre la figure 2.
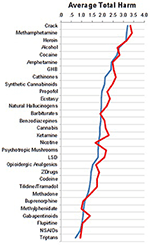
Figure 2. Comparaison des évaluations entre les spécialistes des hôpitaux de soins aigus (n = 76, courbe bleue) par rapport aux hôpitaux de réadaptation (n = 25, courbe rouge).
Comparaison avec la dernière analyse européenne
Cette enquête allemande actualisée a évalué la méthadone, la nicotine, le cannabis et l’alcool comme moins nocifs que ne l’ont fait les évaluateurs de l’UE en 2014 (10), tandis que les champignons psychotropes, les cathinones, l’ecstasy, le GHB, la méthamphétamine et le crack ont été jugés plus nocifs – voir la figure 3.
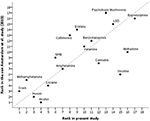
Figure 3. Corrélation entre la présente évaluation et la dernière évaluation de l’UE (10) de la nocivité globale des drogues d’abus (rs = 0,73). Pour une meilleure orientation, la bissectrice indique une corrélation parfaite (rs = 1).
Contrôle de plausibilité et test de sensibilité
Les écarts les plus faibles entre le classement moyen de la nocivité globale et les 5 classements des dimensions sanitaires et sociales ont été constatés pour les drogues illégales traditionnelles que sont le crack (et les autres cocaïnes), l’héroïne, la méthamphétamine, ainsi que pour l’alcool, qui ont également été classés aux premières places en termes de nocivité. Il en va de même pour le GHB et les NPS qui se classent près du sommet, la kétamine au milieu, les opioïdes dans les fourchettes inférieures et la plupart des NOA (gabapentinoïdes, flupirtine, triptans) dans les rangs les plus bas. Des divergences frappantes ont été observées pour le propofol, le cannabis, la nicotine et les AINS (tableau 2). Dans le cas de la nicotine et des AINS, des préoccupations disproportionnées en matière de dommages physiques (par exemple, le cancer, les accidents vasculaires cérébraux, les maladies coronariennes, les BPCO pour le premier et les saignements gastro-intestinaux, les maladies rénales et cardiovasculaires pour le second) expliquent probablement la majeure partie de l’écart pour ces substances. Dans le cas du cannabis, la littérature allemande reflète actuellement une perception générale de méfaits physiques relativement faibles et, à l’inverse, une perception de méfaits psychosociaux élevés pour les usagers, cette dichotomie servant à corroborer la divergence ici (29-31). La divergence pour la nicotine (et peut-être aussi pour le propofol dans une certaine mesure) peut être due en partie à un classement étonnamment bas des dommages psychologiques pour les utilisateurs qui diverge des preuves empiriques. Cette sous-estimation potentielle peut donc menacer la validité des classements généraux des méfaits de ces substances spécifiques.
Lorsque nous avons utilisé les pondérations consensuelles de l’étude d’évaluation de l’UE (10) comme test de sensibilité de comparaison, nous avons constaté que le classement des méfaits globaux qui en résultait (figure 9 supplémentaire) était très similaire aux classements pondérés dérivés de notre enquête présentés dans la figure 1 (voir le tableau 2 supplémentaire pour comparaison). Cela suggère que les pondérations aberrantes/différentes des dimensions individuelles (tableau supplémentaire 1) n’influencent pas de manière critique les classements des méfaits globaux qui en résultent dans notre étude.
Discussion
Nos données corroborent la situation dans de nombreux autres pays (5-10) de discordance entre les classements des méfaits des drogues populaires par les experts et leur réglementation par les lois sur les stupéfiants, comme le montre de manière très frappante l’évaluation de l’alcool – jugé comme l’une des substances les plus nocives consommées dans notre pays. La prévalence relativement élevée de l’usage/abus d’alcool (par rapport à celle de substances moins fréquemment consommées mais peut-être plus dangereuses) contribue probablement à son classement par dimension, par exemple les dommages causés à autrui, ainsi qu’à sa position globale. De même, la baisse de la prévalence de la consommation de nicotine en Allemagne (le tabagisme ayant été interdit dans de nombreux lieux publics tels que les hôpitaux, les établissements d’enseignement, les transports publics, les restaurants, les pubs et les discothèques au cours des dix dernières années environ) peut contribuer à un classement des dommages plus faible que prévu. En outre, il convient de mentionner que la consommation de nicotine, malgré sa capacité à produire une dépendance comportementale considérable, n’est guère associée à des effets psychiatriques dramatiques, contrairement à la consommation d’alcool ou d’hallucinogènes, par exemple. Cette étude est la première à comparer les méfaits de divers NOA aux méfaits de substances d’abus bien caractérisées et, comme prévu, elle identifie les méfaits des NOA comme étant considérablement plus faibles que ceux des substances d’abus traditionnelles. La présente étude est également la première à inclure les cannabinoïdes synthétiques et le propofol dans un schéma de classement des méfaits globaux, ce qui peut être bénéfique pour la psychoéducation des utilisateurs, pour des considérations réglementaires ou pour définir des champs d’action politique pour la promotion de la santé.
Les NPS (cathinones et cannabinoïdes synthétiques) ont été assignés au groupe de niveau de méfaits supérieur ici. Les décideurs politiques et les cliniciens bénéficieraient de données supplémentaires sur le phénomène des NPS, par exemple la morbidité (32, 33) et la mortalité associées qui sont en augmentation (33).
Par rapport à l’évaluation de l’UE de 2014 (10), le cannabis, la méthadone et la nicotine ont été évalués comme moins nocifs, tandis que le crack, la méthamphétamine, le GHB, les cathinones, l’ecstasy et les champignons psychotropes ont été considérés comme plus nocifs (Figure 3). Le cannabis et les hallucinogènes (c’est-à-dire la kétamine, les champignons psychotropes et le LSD) ont été considérés comme étant au même niveau de nocivité que les benzodiazépines ou les barbituriques. Il convient de mentionner que la psilocybine (dans la figure 1, listée comme champignons psychotropes) et le LSD ont tous deux bénéficié d’un potentiel thérapeutique réémergent dans les maladies psychiatriques et semblent présenter un faible potentiel d’abus dans ce contexte (34).
Il est intéressant de noter que les analgésiques opioïdes ne figuraient pas dans les premiers rangs des médicaments nocifs. Cela pourrait peut-être être lié au fait qu’une « épidémie d’opioïdes » (comme celle qui sévit aux États-Unis, au Canada et en Australie) n’est pas encore apparente en Allemagne ou en Europe occidentale (35-38). Le classement relativement faible des opioïdes de prescription dans notre étude contraste fortement avec le niveau élevé de stigmatisation des opioïdes illicites. Ces résultats concordent avec l’analyse multi-décisionnelle de neuf experts (8 du Royaume-Uni et 1 des Pays-Bas) suggérant que les méfaits globaux des opioïdes de prescription non utilisés médicalement sont moins de la moitié de ceux de l’héroïne de rue injectée (39).
La méthadone a été évaluée comme moins nocive que les analgésiques opioïdes standard, ce point de vue pouvant être biaisé par la conception qu’ont les médecins spécialisés dans la médecine de l’addiction de la méthadone principalement en tant que traitement d’entretien standard de la dépendance aux opioïdes, qui dans ce contexte s’est avéré à plusieurs reprises réduire la morbidité et la mortalité (15). Dans le contexte de l’usage et de l’abus illicites, les méfaits de la méthadone (par exemple, les décès par apnée et torsades de pointes, la dépendance et le détournement) sont évidemment considérablement plus élevés que ceux de plusieurs autres drogues classées au-dessus d’elle. Cela met en évidence une limite majeure des études de classement des effets nocifs des médicaments fondées sur des évaluations subjectives, car elles ne permettent pas toujours de faire une distinction claire entre les effets nocifs d’un médicament ayant une indication thérapeutique dans un contexte médical et ceux d’un usage illicite ou d’un mauvais usage en dehors de ce contexte. Ces divergences dans le classement des analgésiques parmi d’autres agents suggèrent que l’expérience des évaluateurs en matière de médecine de la douleur aurait peut-être dû faire l’objet d’une enquête également.
On ne peut exclure que nos évaluations soient biaisées par la perception métropolitaine plutôt que rurale des méfaits de la consommation de substances ; clarifier cela nécessiterait une étude plus approfondie dans des échantillons plus importants. De même, une éventuelle influence du sexe sur la perception des méfaits de la drogue n’a pas été explicitement étudiée ici (40, 41). Comme nous avions envoyé les questionnaires sans suivre tous les destinataires, en demandant de les transmettre à d’autres experts allemands en médecine des dépendances, nous ne sommes pas en mesure de fournir des informations sur le nombre exact d’experts qui ont finalement reçu nos questionnaires. Cependant, un tel modus operandi n’est pas inhabituel pour des études de ce type (5). D’autres limites, similaires à celles des études précédentes (5-10), incluent le fait que le présent travail ne peut prétendre répondre à des exigences strictes de représentativité. Nous avons cherché à réduire les biais de subjectivité en recrutant un groupe d’étude important et homogène (tous les médecins spécialisés dans la médecine de l’addiction). Cependant, il n’existe pas de statistiques officielles sur le nombre de spécialistes ayant plus de 5 ans d’expérience dans le domaine des soins tertiaires des MST qui travaillaient en Allemagne au moment de l’étude. Nous estimons que ce nombre se situe entre 250 et 500 médecins, de sorte que notre échantillon peut donner un point de vue minoritaire. En Allemagne, les experts en médecine de l’addiction sont généralement des psychiatres ou des médecins généralistes. Contrairement aux études anglaises (5), européennes (10) et australiennes (9), nous n’avons pas eu recours à des retours de consensus. Bien que cette étape supplémentaire ait pu augmenter la probabilité d’un accord des participants à l’enquête (42), nous avons décidé de ne pas suivre cette voie, car les décisions consensuelles en soi n’éliminent pas la subjectivité (43) et il n’existe pas de » méthode unique » pour l’évaluation des avantages et des risques (44). En outre, les études antérieures fondées sur le consensus ont utilisé des échantillons plus petits comprenant des experts en toxicomanie de différentes professions (5, 9, 10), dont l’hétérogénéité des expériences en matière de traitement des MSI nécessitait plus probablement une stratégie de décision fondée sur le consensus que notre groupe homogène. Comme les groupes de recherche néerlandais (6), écossais (7) et français (8), nous avons procédé à une évaluation « ad hoc », en utilisant des dimensions sanitaires et sociales validées, qui ont été utilisées dans des études empiriques antérieures (5, 10) et récentes (9). Cette décision d’utiliser un format « ad hoc » a permis de maximiser le retour des questionnaires remplis.
En dehors de l’inclusion inédite des NOA, des cannabinoïdes synthétiques et du propofol, la présente étude présente quelques points forts : (i) l’utilisation de l’un des plus grands échantillons dans ce type d’étude ; (ii) l’expérience multidimensionnelle considérable en médecine de la toxicomanie des participants, y compris celle des spécialistes des cliniques de réadaptation (figure 2), qui en Allemagne se concentre fortement sur les dimensions et les résultats psychosociaux ; (iii) la comparaison avec le classement précédent de l’UE (figure 3) ; et (iv) l’ajout de comparaisons des classements des drogues illicites et licites à la littérature actuelle.
Les résultats de cette étude transversale par questionnaire mettent à jour le préjudice global moyen (avec les préjudices composants de diverses dimensions sanitaires et sociales) découlant de l’usage/du mésusage de diverses substances psychoactives (y compris les analgésiques sur ordonnance) du point de vue des spécialistes allemands de la médecine des dépendances. Il convient toutefois de souligner que ces classements globaux relatifs s’appliquent à des risques au niveau de la population et que, selon le contexte individuel et situationnel ainsi que l’intensité du mésusage individuel, presque toutes les substances psychoactives peuvent être utilisées de manière très dangereuse et nocive.
Conclusion
Cette étude fournit un classement actualisé par les experts allemands en médecine des addictions des méfaits globaux moyens ainsi que des méfaits dans des dimensions sanitaires et sociales spécifiques de diverses substances psychoactives, y compris les analgésiques. L’alcool est considéré comme l’une des substances addictives les plus nocives, avec l’héroïne, la cocaïne, la méthamphétamine, le GHB et les NPS (c’est-à-dire les cannabinoïdes synthétiques et les cathinones). Les risques élevés de l’alcool sont quelque peu en désaccord avec la loi allemande sur les stupéfiants, comme dans la plupart des pays. Le cannabis et la kétamine ont été classés dans la moyenne, au même titre que les benzodiazépines. Les médicaments utilisés à des fins thérapeutiques, tels que les analgésiques non opioïdes, le méthylphénidate et les opioïdes, ont été estimés dans l’ensemble comme étant les moins dangereux à l’heure actuelle. Une telle perception de sécurité relative est cependant certainement sujette à changement si les modèles de mauvaise utilisation et d’abus évoluent avec le temps (45).
Data Availability Statement
Les données brutes soutenant les conclusions de cet article seront mises à disposition par les auteurs, sans réserve indue.
Ethics Statement
Les études impliquant des participants humains ont été examinées et approuvées par Ethik-Kommission der Medizinischen Fakultät der Universität Duisburg-Essen. Le consentement éclairé écrit pour la participation n’était pas requis pour cette étude, conformément à la législation nationale et aux exigences institutionnelles.
Contributions des auteurs
UB : conception et design. MSp : analyse des données. UB et MSp : collecte et interprétation des données. UB : rédaction de l’article. Tous les auteurs : révision critique pour le contenu intellectuel important.
Conflit d’intérêt
NS a reçu des honoraires pour plusieurs activités (par exemple, participation à un conseil consultatif, conférences, manuscrits) de AbbVie, Camurus, Hexal, Janssen-Cilag, MSD, Medice, Mundipharma, Reckitt-Benckiser/Indivior et Sanofi-Aventis. Au cours des 3 dernières années, il a participé à des essais cliniques financés par l’industrie pharmaceutique. TA a reçu des honoraires (par exemple, en tant que membre d’un conseil consultatif) et/ou des subventions à l’éducation de la part de Janssen-Cilag, Medice et Otsuka-Lundbeck. NW a reçu des honoraires pour des conférences (non liées à un produit) (Janssen-Cilag, mundipharma et Reckitt-Benckiser/Indivior), Au cours des trois dernières années, il a participé à des essais cliniques financés par l’industrie pharmaceutique et a reçu un financement public (BayStMGP) pour l’évaluation de Take-Home Naloxone. TH a reçu des honoraires pour plusieurs activités (par exemple, membre d’un conseil consultatif, conférences) de Janssen-Cilag, Amomed, Shire, Takeda, Servier MSo a travaillé comme consultant ou a reçu des honoraires de conférencier de Ammomed, Indivior, Camurus au cours des 3 dernières années. JR a reçu des honoraires pour sa participation à des conseils consultatifs, des consultations et des conférences de AbbVie, Camurus, Gilead, Hexal, Indivior et Sanofi-Aventis. JK a reçu des honoraires de Bayer, Janssen, Lundbeck, Neuraxpharm, Otsuka Pharma, Schwabe et Servier pour des conférences et un soutien financier pour ses déplacements. Il a reçu un soutien financier de Medtronic GmbH pour des essais initiés par des chercheurs. HM est également affilié à une praxis privée (Northern Anesthesia ; Pain Medicine, LLC, Eagle River, AK, USA), qui n’a aucun rapport avec cette étude.
Les autres auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions cordialement Jennifer Haverkemper, MSc (psychologie), pour son aide à l’élaboration du questionnaire de la Cohorte 1, et Ann-Christin Kanti, MD, pour la saisie et la maintenance des données. Nous remercions également Gabriele Lührmann, secrétaire en chef du département de psychiatrie, psychothérapie et psychosomatique de l’EVK Castrop-Rauxel, pour avoir organisé la correspondance avec les collègues. Nous remercions également les nombreux médecins qui ont gentiment pris le temps de participer à ce projet.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fpsyt.2020.592199/full#supplementary-material
1. Korpi ER, den Hollander B, Farooq U, Vashchinkina E, Rajkumar R, Nutt DJ, et al. Mécanismes d’action et neuroplasticité persistante par les drogues d’abus. Pharmacol Rev. (2015) 67:872-1004. doi : 10.1124/pr.115.010967
CrossRef Full Text | Google Scholar
2. Morgen K. Counseling et identité professionnelle au 21e siècle. Troubles liés à l’utilisation de substances et dépendances. Thousand Oaks, CA : Sage Publications, Inc (2017).
Google Scholar
3. APA American Psychiatric Association. Manuel diagnostique et statistique des troubles mentaux. 5th ed. Washington, DC : APA (2013).
Google Scholar
4. Dilling H, Freyberger H. Taschenführer zur ICD-10-Klassifikation psychischer Störungen. Berne : Huber Verlag (2006).
Google Scholar
5. Nutt DJ, King LA, Phillips LD. Comité scientifique indépendant sur les drogues. Les méfaits des drogues au Royaume-Uni : une analyse décisionnelle multicritères. Lancet. (2010) 376:1558-65. doi : 10.1016/S0140-6736(10)61462-6
CrossRef Full Text | Google Scholar
6. van Amsterdam J, Opperhuizen A, Koeter M, van den Brink W. Ranking the harm of alcohol, tobacco and illicit drugs for the individual and the population. Eur Addict Res. (2010) 16:202-7. doi : 10.1159/000317249
CrossRef Full Text | Google Scholar
7. Taylor M, Mackay K, Murphy J, McIntosh A, McIntosh C, Anderson S, et al. Quantifier le RR de préjudice pour soi et les autres à partir de l’abus de substances : résultats d’une enquête auprès des experts cliniques à travers l’Écosse. BMJ Open. (2012) 2:e000774. doi : 10.1136/bmjopen-2011-000774
CrossRef Full Text | Google Scholar
8. Bourgain C, Falissard B, Blecha L, Benyamina A, Karila L, Reynaud M. Une évaluation dommage/bénéfice de la consommation de produits addictifs. Addiction. (2012) 107:441-50. doi : 10.1111/j.1360-0443.2011.03675.x
CrossRef Full Text | Google Scholar
9. Bonomo Y, Norman A, Biondo S, Bruno R, Daglish M, Dawe S, et al. The Australian drug harms ranking study. J Psychopharmacol. (2019) 33:759-68. doi : 10.1177/0269881119841569
CrossRef Full Text | Google Scholar
10. van Amsterdam J, Nutt D, Phillips L, van den Brink W. European rating of drug harms. J Psychopharmacol. (2015) 29:655-60. doi : 10.1177/0269881115581980
CrossRef Full Text | Google Scholar
11. DSB (Drogen und Suchtbericht 2018). Die Drogenbeauftragte der Bundesregierung. (2018). Disponible en ligne à l’adresse suivante : https://www.drogenbeauftragte.de/fileadmin/dateien-dba/Drogenbeauftragte/Drogen_und_Suchtbericht/pdf/DSB-2018.pdf (consulté le 6 janvier 2020).
Google Scholar
12. Atzendorf J, Rauschert C, Seitz N, Lochbühler K, Kraus L. La consommation d’alcool, de tabac, de drogues illégales et de médicaments. Une estimation de la consommation et des troubles liés aux substances en Allemagne. Dtsch Arztebl Int. (2019) 116:577-84. doi : 10.3238/arztebl.2019.0577
CrossRef Full Text | Google Scholar
13. Seitz NN, Lochbühler K, Atzendorf J, Rauschert C, Pfeiffer-Gerschel T, Kraus L. Trends in substance use and related disorders-analysis of the epidemiological survey of substance abuse 1995 to 2018. Dtsch Arztebl Int. (2019) 116:585-91. doi : 10.3238/arztebl.2019.0585
CrossRef Full Text | Google Scholar
14. Scherbaum N, Schifano F, Bonnet U. New psychoactive substances (NPS) – a challenge for the addiction treatment services. Pharmacopsychiatrie. (2017) 50:116-22. doi : 10.1055/s-0043-102059
CrossRef Full Text | Google Scholar
15. Dematteis M, Auriacombe M, D’Agnone O, Somaini L, Szerman N, Littlewood R, et al. Recommandations pour le traitement par buprénorphine et méthadone dans le trouble de l’usage des opioïdes : un consensus européen. Expert Opin Pharmacother. (2017) 18:1987-99. doi : 10.1080/14656566.2017.1409722
CrossRef Full Text | Google Scholar
16. Chandra S, Radwan MM, Majumdar CG, Church JC, Freeman TP, ElSohly MA. Nouvelles tendances de la puissance du cannabis aux États-Unis et en Europe au cours de la dernière décennie (2008-2017). Eur Arch Psychiatry Clin Neurosci. (2019) 269:5-15. doi : 10.1007/s00406-019-00983-5
CrossRef Full Text | Google Scholar
17. Di Forti M, Quattrone D, Freeman TP, Tripoli G, Gayer-Anderson C, Quigley H, et al. The contribution of cannabis use to variation in the incidence of psychotic disorder across Europe (EU-GEI) : a multicentre case-control study. Lancet Psychiatry. (2019) 6:427-36. doi : 10.1016/S2215-0366(19)30048-3
CrossRef Full Text | Google Scholar
18. OEDT Observatoire européen des drogues et des toxicomanies. 2018 Utilisation médicale du cannabis et des cannabinoïdes : Questions et réponses pour l’élaboration des politiques. Luxembourg : Office des publications de l’Union européenne (2018). Disponible en ligne à l’adresse suivante : http://www.emcdda.europa.eu/system/files/publications/10171/20185584_TD0618186ENN_PDF.pdf (consulté le 6 janvier 2020).
Google Scholar
19. Bonnet U. Évaluation du risque addictif du propofol. Fortschr Neurol Psychiatry. (2011) 79:442-52. doi : 10.1055/s-0031-1273411
CrossRef Full Text | Google Scholar
20. Beau-Salinas F, Jonville-Béra AP, Cissoko H, Bensouda-Grimaldi L, Autret-Leca E. Drug dependence associated with triptans and ergot derivatives : a case/non-case study. Eur J Clin Pharmacol. (2010) 66:413-7. doi : 10.1007/s00228-009-0769-6
CrossRef Full Text | Google Scholar
21. Gahr M, Freudenmann RW, Connemann BJ, Hiemke C, Schönfeldt-Lecuona C. Abuse liability of flupirtine revisited : implications of spontaneous reports of adverse drug reactions. J Clin Pharmacol. (2013) 53:1328-33. doi : 10.1002/jcph.164
CrossRef Full Text | Google Scholar
22. Evoy KE, Morrison MD, Saklad SR. Abus et mésusage de la prégabaline et de la gabapentine. Médicaments. (2017) 77:403-26. doi : 10.1007/s40265-017-0700-x
CrossRef Full Text | Google Scholar
23. Bonnet U, Scherbaum N. How addictive are gabapentin and pregabalin ? Une revue systématique. Eur Neuropsychopharmacol. (2017) 27:1185-2015. doi : 10.1016/j.euroneuro.2017.08.430
CrossRef Full Text | Google Scholar
24. Bonnet U, Strasser JC, Scherbaum N. Screening for physical and behavioral dependence on non-opioid analgesics in a German elderly hospital population. Addict Behav. (2019) 90:265-71. doi : 10.1016/j.addbeh.2018.11.009
CrossRef Full Text | Google Scholar
25. Etcheverrigaray F, Grall-Bronnec M, Blanchet M, Jolliet P, Victorri-Vigneau C. Dépendance à l’ibuprofène : un rapport de cas. Pharmacopsychiatrie. (2014) 47:115-7. doi : 10.1055/s-0034-1371868
CrossRef Full Text | Google Scholar
26. Godersky ME, Vercammen LK, Ventura AS, Walley AY, Saitz R. Identification of non-steroidal anti-inflammatory drug use disorder : a case report. Addict Behav. (2017) 70:61-4. doi : 10.1016/j.addbeh.2017.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Cryer B, Barnett MA, Wagner J, Wilcox CM. Surutilisation et perceptions erronées des anti-inflammatoires non stéroïdiens aux États-Unis. Am J Med Sci. (2016) 352:472-80. doi : 10.1016/j.amjms.2016.08.028
CrossRef Full Text | Google Scholar
28. Wójta-Kempa M, Krzyzanowski DM. Corrélats de l’abus et du mauvais usage des analgésiques en vente libre parmi la population adulte de Wrocław (Pologne). Adv Clin Exp Med. (2016) 25:349-60. doi : 10.17219/acem/58887
CrossRef Full Text | Google Scholar
29. Hölscher F, Bonnet U, Scherbaum N. Utilisation d’un centre de traitement ambulatoire pour l’abus de cannabis. Nervenarzt. (2008) 79:571-6. doi : 10.1007/s00115-008-2412-7
CrossRef Full Text | Google Scholar
30. Bonnet U, Specka M, Scherbaum N. Usage fréquent de cannabis à des fins non médicales : séquelles sur la santé et efficacité du traitement de désintoxication. Dtsch Med Wochenschr. (2016) 141:126-31. doi : 10.1055/s-0041-106313
CrossRef Full Text | Google Scholar
31. Schneider D. Konsumfolgen und Behandlungsbedarf von Cannabis-Intensivkonsumenten/innen im ambulanten setting. Sucht. (2016) 62:23-30. doi : 10.1024/0939-5911/a000405
CrossRef Full Text | Google Scholar
32. Foti F, Marti M, Ossato A, Bilel S, Sangiorgi E, Botrè F, et al. Effets phénotypiques de l’utilisation chronique et aiguë de la méthiopropamine dans un modèle de souris. Int J Legal Med. (2019) 133:811-20. doi : 10.1007/s00414-018-1891-8
CrossRef Full Text | Google Scholar
33. Corkery JM, Schifano F, Martinotti G. How deaths can help clinicians and policy-makers understand the risks of novel psychoactive substances. Br J Clin Pharmacol. (2020) 86:482-98. doi : 10.1111/bcp.14183
CrossRef Full Text | Google Scholar
34. Chi T, Gold JA. Un examen du potentiel thérapeutique émergent des drogues psychédéliques dans le traitement des maladies psychiatriques. J Neurol Sci. (2020) 411:116715. doi : 10.1016/j.jns.2020.116715
CrossRef Full Text | Google Scholar
35. Häuser W, Schug S, Furlan AD. L’épidémie d’opioïdes et les directives nationales pour le traitement opioïde de la douleur chronique non cancéreuse : une perspective de différents continents. Pain Rep. (2017) 2:e599. doi : 10.1097/PR9.0000000000000599
CrossRef Full Text | Google Scholar
36. Kraus L, Seitz NN, Schulte B, Cremer-Schaeffer P, Braun B, Verthein U, et al. Estimation du nombre de personnes souffrant de dépendance aux opioïdes en Allemagne. Dtsch Arztebl Int. (2019) 116:137-43. doi : 10.3238/arztebl.2019.0137
CrossRef Full Text | Google Scholar
37. Rosner B, Neicun J, Yang JC, Roman-Urrestarazu A. Les modèles de prescription d’opioïdes en Allemagne et l’épidémie mondiale d’opioïdes : examen systématique des preuves disponibles. PLoS ONE. (2019) 14 : e0221153. doi : 10.1371/journal.pone.0221153
CrossRef Full Text | Google Scholar
38. Meyer A, LeClair C, McDonald JV. Prescription d’opioïdes sur ordonnance en Europe occidentale et aux États-Unis. R I Med J. (2020) 103:45-8.
Google Scholar
39. van Amsterdam J, Phillips L, Henderson G, Bell J, Bowden-Jones O, Hammersley R, et al. Ranking the harm of non-medically used prescription opioids in the UK. Regul Toxicol Pharmacol. (2015) 73:999-1004. doi : 10.1016/j.yrtph.2015.09.014
CrossRef Full Text | Google Scholar
40. Bodnar RJ, Kest B. Sex differences in opioid analgesia, hyperalgesia, tolerance and withdrawal : central mechanisms of action and roles of gonadal hormones. Horm Behav. (2010) 58:72-81. doi : 10.1016/j.yhbeh.2009.09.012
CrossRef Full Text | Google Scholar
41. Di Nicola M, Ferri VR, Moccia L, Panaccione I, Strangio AM, Tedeschi D, et al. Gender differences and psychopathological features associated with addictive behaviors in adolescents. Front Psychiatry. (2017) 8:256. doi : 10.3389/fpsyt.2017.00256
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Phillips LD, Banae Costa CA. Priorité transparente, budgétisation et allocation des ressources avec l’analyse de décision multicritères et la conférence de décision. Ann Operat Res. (2007) 154:51-68. doi : 10.1007/s10479-007-0183-3
CrossRef Full Text | Google Scholar
43. Rolles S, Measham F. Questioning the method and utility of ranking drug harms in drug policy. Int J Drug Policy. (2011) 22:243-6. doi : 10.1016/j.drugpo.2011.04.004
CrossRef Full Text | Google Scholar
44. Mt-Isa S, Hallgreen CE, Wang N, Callréus T, Genov G, Hirsch I, Hobbiger SF, et al. Balancing benefit and risk of medicines : a systematic review and classification of available methodologies. Pharmacoepidemiol Drug Saf . (2014) 23:667-78. doi : 10.1002/pds.3636
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Martinotti G, de Risio L, Vannini C, Schifano F, Pettorruso M, Di Giannantonio M. Substance related exogenous psychosis : a post-modern syndrome. CNS Spectr. (2020) 1-8. doi : 10.1017/S1092852920001479
CrossRef Full Text | Google Scholar