Introduction
Le cerveau humain subit une maturation importante tout au long de la vie pour faciliter le développement cognitif. La myélinisation des axones dans tout le système nerveux est l’un de ces processus de maturation cruciaux. Dans le système nerveux central (SNC), les cellules gliales appelées oligodendrocytes étendent de nombreux processus dans leur milieu environnant, qui enroulent concentriquement la membrane autour des axones pour former des gaines de myéline. Les gaines de myéline permettent la conduction saltatoire rapide des potentiels d’action en localisant les canaux Na+ dépendants du voltage dans de courts espaces entre les gaines adjacentes (appelés nœuds de Ranvier) et en agissant comme des isolants électriques. Les axones entièrement myélinisés sur toute leur longueur conduisent les impulsions plusieurs fois plus rapidement que les axones non myélinisés de même section transversale (Waxman, 1980). Par conséquent, les circuits neuronaux myélinisés conduisent l’information beaucoup plus rapidement que les circuits non myélinisés. À la naissance, le SNC de l’être humain n’est pratiquement pas myélinisé. La population d’oligodendrocytes s’accroît considérablement après la naissance et la myélinisation est généralisée au cours des premières années de l’enfance. La myélinisation se poursuit à l’adolescence et à l’âge adulte d’une manière spatio-temporelle caractéristique, en corrélation avec l’émergence et le maintien d’un fonctionnement correct des circuits. Par exemple, la maturation de la substance blanche (les zones riches en myéline du SNC) est concomitante au développement des processus cognitifs de l’enfance, tels que la vitesse de traitement de l’information (Mabbott et al., 2006 ; Scantlebury et al., 2014). De plus, des pathologies/anomalies de la myéline sont observées non seulement dans la maladie démyélinisante qu’est la sclérose en plaques, mais aussi dans plusieurs maladies neurodégénératives (Kang et al., 2013 ; Huang et al., 2015) et dans des troubles du développement neurologique (Takahashi et al., 2011). Cependant, la myélinisation des axones individuels n’est pas un phénomène » tout ou rien « . Les axones du SNC présentent des variations importantes en termes de nombre de gaines de myéline, de longueur de gaine, d’épaisseur de gaine et de distribution sur leur longueur. Il existe de nombreux modèles de myélinisation différents ; par exemple, des axones présentant des régions faiblement myélinisées ont été décrits dans le cortex de souris juvéniles et adultes (Tomassy et al., 2014 ; Hill et al., 2018 ; Hughes et al., 2018). La modification de l’un de ces paramètres de gaine a des effets prévisibles sur la vitesse de conduction de l’axone sous-jacent – par conséquent, l’établissement d’un modèle spécifique de myélinisation le long d’un axone peut être particulièrement important pour affiner la fonction du circuit. Par exemple, les axones du tronc cérébral auditif des gerbilles présentent des gaines de myéline de plus en plus courtes le long des régions distales afin d’assurer un timing précis de l’arrivée du signal pour faciliter la localisation du son (Ford et al., 2015). Des changements subtils dans le schéma global de la myélinisation le long d’un axone (soit par l’ajout de nouvelle myéline, soit par le remodelage de la myéline existante) pourraient modifier profondément la synchronisation des impulsions neuronales dans les circuits. Si la myéline est adaptable, la modification de ces schémas de myélinisation pourrait représenter un mécanisme puissant de régulation de la fonction des circuits tout au long de la vie.
Des preuves récentes suggèrent que la myéline pourrait être adaptable en réponse à l’activité des circuits. L’imagerie du tenseur de diffusion du cerveau entier peut être utilisée pour mesurer les larges changements dans la matière blanche riche en myéline au fil du temps – de telles expériences chez l’homme et les rongeurs ont montré que l’apprentissage d’une nouvelle tâche est corrélé avec des altérations de la matière blanche dans les régions cérébrales pertinentes (Scholz et al., 2009 ; Sampaio-Baptista et al., 2013). Des analyses au niveau cellulaire dans des modèles animaux démontrent que la production de nouveaux oligodendrocytes myélinisants est nécessaire pour un apprentissage moteur efficace (McKenzie et al., 2014 ; Xiao et al., 2016). L’hypothèse actuelle est que l’activité des circuits neuronaux peut déclencher des modifications de la myéline ; de nombreuses recherches ont démontré que l’activité neuronale peut influencer la prolifération des cellules précurseurs d’oligodendrocytes (OPC), la différenciation des oligodendrocytes, ainsi que la formation et la croissance des gaines de myéline. Ces recherches, y compris les preuves des signaux moléculaires impliqués, ont été largement examinées ailleurs (Fields, 2015 ; Almeida et Lyons, 2017 ; Mount et Monje, 2017). L’activité neuronale pourrait entraîner des modifications de la myéline qui, à son tour, pourrait modifier les vitesses de conduction pour affiner les timings qui sous-tendent la fonction des circuits.
Cependant, nous ne savons toujours pas si ou comment la myélinisation des circuits est régulée dynamiquement tout au long de la vie. Les travaux sur les rongeurs indiquent que de nouveaux oligodendrocytes sont générés dans tout le SNC, même à l’âge adulte (Young et al., 2013), et les OPC résident dans le cerveau humain adulte (Chang et al., 2000). L’analyse de la datation au carbone de tissus humains a permis d’identifier des oligodendrocytes nés à l’âge adulte dans le cortex, bien que les mêmes analyses aient indiqué que la majorité des oligodendrocytes dans le corps calleux proviennent de la petite enfance (Yeung et al., 2014). Cependant, les études de neuro-imagerie chez l’homme qui établissent une corrélation entre les altérations structurelles de la substance blanche et l’apprentissage de tâches suggèrent que la nouvelle myéline peut se former tout au long de la vie. Une myélinisation aussi prolongée nécessiterait en principe une production d’oligodendrocytes tout au long de la vie, étant donné que les oligodendrocytes myélinisants individuels disposent d’une fenêtre temporelle restreinte de quelques heures seulement pour initier la formation de nouvelles gaines (Watkins et al., 2008 ; Czopka et al., 2013) et que le nombre de gaines par oligodendrocyte semble stable dans le temps (Tripathi et al., 2017). Mount et Monje (2017) font remarquer que la date de » naissance » dans l’expérience de datation au carbone (qui identifie le moment de la réplication de l’ADN pendant la division cellulaire), reflète celle de l’OPC, et pas nécessairement de l’oligodendrocyte différencié. Ceci est important étant donné les preuves que les OPC peuvent se différencier directement en oligodendrocytes sans division cellulaire, au moins chez les rongeurs (Hughes et al., 2013). Les OPC du corps calleux pourraient se différencier directement en oligodendrocytes de nombreuses années après leur division cellulaire terminale ; le moment de la différenciation de ces nouveaux oligodendrocytes ne peut donc pas être déterminé par datation au carbone, et Yeung et al. (2014) pourraient donc avoir sous-estimé le taux de production d’oligodendrocytes dans le cerveau humain adulte. Nous avons encore beaucoup à apprendre sur les contributions relatives de la génération d’oligodendrocytes et du remodelage de la myéline au développement du SNC tout au long de la vie.
Pour comprendre pleinement la dynamique précise de l’oligodendrogenèse, de la formation de la myéline et du remodelage de la myéline au cours des différentes étapes de la vie, l’imagerie longitudinale à haute résolution représente l’approche de référence. Nous fournissons ici un aperçu des études récentes d’imagerie in vivo qui commencent à clarifier la dynamique de la myélinisation, ce qui nous permettra également de commencer à comprendre comment une telle dynamique pourrait avoir un impact sur la fonction des circuits neuronaux.
Myélinisation de novo
Pour commencer à aborder définitivement la façon dont les oligodendrocytes sont générés et comment la myéline est fabriquée et dynamiquement remodelée in vivo, deux études récentes ont utilisé l’imagerie répétée à deux photons du cortex somatosensoriel de la souris sur des périodes prolongées. Hughes et al. (2018) ont imagé le cortex de souris rapporteuses transgéniques avec des cellules de la lignée oligodendrogliale marquées par fluorescence depuis le début de l’âge adulte jusqu’à l’âge moyen et avancé (environ P720). Ils ont constaté que la population d’oligodendrocytes continue de s’étendre et que la densité des oligodendrocytes corticaux double presque entre le stade de jeune adulte et celui d’âge moyen (figure 1A). Ce phénomène s’accompagne d’une multiplication par plus de deux du nombre de gaines de myéline corticales. Mais comment le nombre d’oligodendrocytes augmente-t-il ? Au cours du développement post-natal précoce, de nombreux oligodendrocytes sont produits, mais seul un sous-ensemble survit et poursuit la myélinisation des axones (Barres et al., 1992). Cette situation semble être similaire à l’âge adulte – en suivant des OPC corticaux individuels dans le cortex adulte pendant 50 jours, Hughes et al. (2018) ont révélé que la majorité des oligodendrocytes nouvellement différenciés subissent une mort cellulaire, avec seulement 22% qui survivent et s’engagent dans la myélinisation (Figure 1B). On ignore encore quelle proportion d’oligodendrocytes nouvellement différenciés est générée à la suite de la division des OPC par rapport à la différenciation directe. Cependant, une fois que les oligodendrocytes s’engagent dans la myélinisation, ils restent stables, sans aucune preuve d’oligodendrocytes myélinisants subissant une mort cellulaire pendant une période d’imagerie de 50 jours.
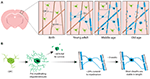
FIGURE 1. Dynamique des oligodendrocytes et de la myéline dans le cortex des mammifères tout au long de la vie. (A) Les cellules précurseurs d’oligodendrocytes (OPCs) génèrent continuellement de nouveaux oligodendrocytes myélinisants (OLs) dans le cortex somatosensoriel de la naissance jusqu’à l’âge moyen. La population d’OL décline ensuite dans la vieillesse, accompagnée d’une réduction de la couverture de myéline. (B) Le traçage de la lignée d’OPC uniques montre que, bien que les OL pré-myélinisants soient continuellement produits à l’âge adulte, seuls environ 20 % d’entre eux survivent jusqu’à la myélinisation. La plupart des gaines de myéline, une fois formées, sont stables en longueur sur une période prolongée, ce qui indique qu’il y a normalement très peu de remodelage de la myéline existante. Résumé des données de Hill et al. (2018) et Hughes et al. (2018).
De même, Hill et al. (2018) ont utilisé des rapporteurs transgéniques d’oligodendrocytes et la technique de microscopie à réflectance confocale spectrale (SCoRe) sans marqueur pour imager la myéline le long des axones (Schain et al., 2014) dans le cortex somatosensoriel de souris juvéniles, jeunes adultes, d’âge moyen et âgées (P950). Ils ont également constaté que le nombre d’oligodendrocytes continue d’augmenter à l’âge adulte jusqu’à P650, et que les oligodendrocytes sont stables à l’âge moyen jusqu’à 80 jours d’imagerie. Ils ont constaté que la myélinisation du cortex atteint également un pic à l’âge moyen, à P650, et que la densité des oligodendrocytes chute de manière significative depuis son pic (à P650) jusqu’à un âge très avancé (P950) (figure 1A). Cela s’est traduit par une réduction de la couverture de myéline des axones corticaux de couche I entre P650 et P950. La survie à long terme des oligodendrocytes peut varier entre les différentes parties du SNC. Tripathi et al. (2017) ont marqué les oligodendrocytes myélinisants à P60 chez la souris, puis ont compté combien de cellules marquées ont survécu jusqu’à P605 dans plusieurs régions du SNC. Ils ont constaté que dans la moelle épinière et le cortex moteur, 60 à 70% des cellules marquées à P60 ont survécu, tandis que dans le corps calleux, plus de 90% des cellules marquées à P60 ont survécu. La réduction du nombre d’oligodendrocytes et de la myélinisation dans certaines régions du SNC avec l’âge soulève des questions intrigantes concernant le rôle de la perte de myéline dans le déclin cognitif associé à l’âge. L’analyse par IRM montre que la microstructure de la substance blanche est en corrélation avec l’intelligence fluide (Ritchie et al., 2015), mais aussi que cette microstructure de la substance blanche se détériore avec l’âge (Cox et al., 2016). La perte de myéline subséquente associée à l’âge pourrait entraîner une réduction de la fonction cognitive en raison d’un dérèglement des circuits myélinisés.
La génération de nouveaux oligodendrocytes (et par la suite de nouvelle myéline) dans le cortex adulte pourrait-elle être sensible à l’activité des circuits ? Des recherches antérieures ont montré que la réduction de l’entrée sensorielle en retirant les moustaches des souris entraîne une réduction de l’oligodendrogenèse dans le cortex somatosensoriel (Hill et al., 2014). Pour approfondir cette question, Hughes et al. (2018) ont fourni à des souris adultes (P365) une stimulation sensorielle pendant 3 semaines en accrochant des perles dans les cages des animaux pour stimuler de manière répétée leurs moustaches et donc le cortex somatosensoriel. En imagerie du cortex somatosensoriel avant et après les 3 semaines, ils ont démontré que la stimulation sensorielle augmente le nombre d’oligodendrocytes, potentiellement en raison de la survie accrue des cellules nouvellement différenciées. Kougioumtzidou et al. (2017) ont fourni d’autres preuves que l’activité du circuit peut être importante dans la régulation de la survie cellulaire – ils ont démontré que la perte des sous-unités 2, 3 et 4 des récepteurs AMPA dans les OPC entraîne une survie réduite des oligodendrocytes. Cela suggère que la myélinisation de novo pourrait être modulée par l’activité des circuits corticaux tout au long de la vie, peut-être pour affiner la fonction de ces mêmes circuits.
De nombreuses questions restent à traiter : quel est l’effet de l’oligodendrogenèse et de la nouvelle myélinisation sur la fonction réelle des circuits ? L’activité neuronale améliore-t-elle la survie à long terme des oligodendrocytes myélinisés ? Il est possible que la perte d’oligodendrocytes dans la vieillesse soit due à la réduction de l’activité neuronale associée à l’âge, ce qui pourrait, à son tour, affecter la survie globale des oligodendrocytes. Il se peut aussi que les oligodendrocytes aient une durée de vie limitée, indépendante de l’activité neuronale (qu’elle soit intrinsèquement programmée ou influencée par d’autres signaux extrinsèques associés au vieillissement). Dans un cas comme dans l’autre, la stimulation du circuit pourrait contribuer à atténuer la perte de myéline associée à l’âge, soit en favorisant la survie des oligodendrocytes existants, soit en stimulant la production de nouveaux oligodendrocytes. Cela pourrait à son tour avoir des implications importantes dans le traitement et la prévention du déclin cognitif associé à l’âge.
L’oligodendrogenèse médiée par l’activité n’est pas limitée au cortex somatosensoriel – les souris jeunes adultes qui subissent un apprentissage moteur montrent également une augmentation du nombre d’oligodendrocytes nouvellement différenciés dans le cortex moteur (Xiao et al., 2016). Qu’en est-il des autres régions du SNC ? De nombreux axones corticaux se projettent via le corps calleux, et par conséquent, la stimulation des circuits corticaux pourrait signaler à la fois les OPC corticaux et callosaux. Deux études sur les rongeurs ont démontré que la stimulation des neurones corticaux induit une oligodendrogenèse au sein du corps calleux. Gibson et al. (2014) ont stimulé par optogénétique les neurones de projection de la couche V dans le cortex prémoteur, et ont constaté une augmentation de la prolifération des OPC dans le cortex prémoteur et le corps calleux. Cela a conduit à une augmentation du nombre d’oligodendrocytes et de l’épaisseur de la gaine 4 semaines après la stimulation. Plus récemment, Mitew et al. (2018) ont utilisé des récepteurs de concepteur activés exclusivement par des médicaments de concepteur pour stimuler les neurones somatosensoriels de la couche 2/3, et ont également observé une augmentation de la prolifération des OPC, de l’oligodendrogenèse et de l’épaisseur des gaines de myéline dans le corps calleux chez les souris juvéniles et adultes. Ils ont également démontré que les nouveaux oligodendrocytes forment préférentiellement des gaines de myéline sur les axones actifs. Cela indique que la myélinisation de novo induite par l’activité peut, en principe, cibler les axones/circuits actifs. On ne sait toujours pas dans quelle mesure les modifications de la myéline en réponse à l’activité neuronale peuvent être durables. La survie à long terme des cellules myélinisantes constatée par Tripathi et al. (2017), Hill et al. (2018) et Hughes et al. (2018) suggère qu’une fois qu’un oligodendrocyte a formé des gaines de myéline, il est susceptible de survivre même si les niveaux d’activité neuronale reviennent au niveau de base. La question de savoir si les gaines de myéline elles-mêmes changent une fois que l’activité neuronale revient à des niveaux normaux nécessite une étude plus approfondie de la dynamique des gaines individuelles, ce qui est discuté ci-dessous.
Il est donc possible que la myélinisation de novo à vie se produise dans de nombreuses régions du SNC, où les axones adaptés à la myélinisation disposent d’un espace non myélinisé suffisant. Cependant, on ne sait toujours pas dans quelle mesure l’oligodendrogenèse se poursuit dans les différentes régions du cerveau humain adulte. Une analyse de datation au carbone suggère que la plupart des oligodendrocytes dans le tractus du corps calleux sont générés dans la petite enfance (Yeung et al., 2014). L’analyse immunohistochimique de tissus cérébraux humains utilisant un nouveau marqueur pour les oligodendrocytes nouvellement différenciés (BCAS1) montre de nouveaux oligodendrocytes dans le cortex frontal même au-delà de l’âge moyen, mais très peu de nouveaux oligodendrocytes dans la substance blanche après la troisième décennie de vie (Fard et al., 2017). Cette différence d’oligodendrogenèse entre les espèces pourrait être le résultat de l’échelle. Les données de Hughes et al. (2013) sur les rongeurs suggèrent que les oligodendrocytes sont générés en énorme excès, avec un élagage continu de près de 80 % des cellules. Compte tenu du coût énergétique d’un tel processus, ce mécanisme est-il viable tout au long de la vie dans un organe de la taille du cerveau humain ? Peut-être que dans le cerveau humain, la surproduction d’oligodendrocytes est limitée, en raison d’un besoin de myélinisation plus prolongée du SNC plus grand, ou parce que des signaux tels que l’activité neuronale stimulent les OPC à se différencier en oligodendrocytes selon les besoins.
Remodelage de la myéline
Le remodelage des gaines de myéline existantes pourrait modifier les propriétés de conduction sans qu’il soit nécessaire de générer de nouveaux oligodendrocytes ou de la myéline. En modifiant la longueur des gaines de myéline existantes, on pourrait changer la couverture de myéline le long d’un axone et la distance entre les nœuds de Ranvier (ce qui aurait un impact sur les vitesses de conduction). En outre, même un remodelage très subtil de la myéline pourrait modifier la longueur des nœuds eux-mêmes. Il a récemment été démontré que la longueur des nœuds peut varier considérablement dans le nerf optique et dans le cortex, et que la modification de la longueur des nœuds le long d’un axone peut, en principe, également modifier de manière significative la vitesse de conduction (Arancibia-Cárcamo et al., 2017). Il reste à déterminer si les modifications du nœud de Ranvier sont principalement motivées par la myélinisation ou la réorganisation de l’axone lui-même.
Tous deux, Hill et al. (2018) et Hughes et al. (2018) ont réalisé une étude longitudinale des gaines de myéline individuelles dans le cortex somatosensoriel de la souris pendant plusieurs semaines pour évaluer si les longueurs de gaine sont dynamiquement régulées. Hill et al. (2018) ont constaté qu’au début de l’âge adulte (P90-120), bien que certaines gaines présentent une extension ou un rétrécissement, 81 % des gaines observées étaient stables. Davantage de gaines peuvent devenir stables en longueur avec l’âge ; Hughes et al. (2018) ont suivi des gaines chez des animaux plus âgés (P365) et ont vu que 99 % des gaines restaient stables sur 3 semaines (Figure 1B).
Une stabilité similaire de la longueur des gaines a également été décrite ailleurs ; Auer et al. (2018) ont utilisé des larves de poisson zèbre pour étudier si les gaines individuelles peuvent changer de longueur au fil du temps en effectuant une imagerie en direct au fil du temps des gaines de myéline marquées par fluorescence. Ils ont constaté que les gaines individuelles subissent une croissance rapide mais variable dans les premiers jours après leur formation, avant de stabiliser leur longueur de gaine. Une fois stabilisées, les gaines ne continuent à croître que pour s’adapter à la croissance globale de l’animal.
Pourquoi certaines gaines du cortex changent-elles de longueur, alors que d’autres non ? Cela peut refléter une diversité dans les exigences de circuits neuronaux distincts. La diversité axonale a été observée pendant la myélinisation initiale dans la moelle épinière du poisson zèbre, où certains axones utilisent la libération de vésicules synaptiques pour réguler le nombre et la longueur des gaines de myéline, tandis que d’autres ne le font pas (Koudelka et al., 2016). Cela soulève l’hypothèse intrigante que seuls certains axones sont capables de réguler la myéline via des signaux liés à l’activité. Hughes et al. (2018) ont constaté que leur paradigme de stimulation sensorielle n’a pas augmenté la proportion de gaines dynamiques dans le cortex somatosensoriel. Cependant, une analyse plus détaillée de la diversité des sous-types d’axones couplée à une étude longitudinale de la dynamique de la longueur des gaines pourrait confirmer si le remodelage de la longueur des gaines est spécifique à certains circuits.
La stabilité de la longueur des gaines reflète-t-elle une incapacité des gaines à se remodeler ? Des expériences menées chez le poisson zèbre suggèrent que le remodelage de la longueur des gaines peut être induit lorsque le profil de myélinisation d’un axone est perturbé. Auer et al. (2018) ont procédé à l’ablation d’oligodendrocytes uniques et ont donc retiré les gaines de manière éparse le long des axones. Ils ont constaté que lorsqu’une seule gaine de myéline est perdue sur un axone entièrement myélinisé, les gaines voisines pouvaient réinitialiser une croissance rapide pour couvrir l’espace non myélinisé. Dans plusieurs cas, une nouvelle gaine de myéline se forme à la place de son prédécesseur et peut même repousser les gaines voisines envahissantes pour restaurer le schéma de myélinisation original (Figure 2A). Par conséquent, il arrive qu’un schéma de myélinisation spécifique soit maintenu de manière préférentielle, même après la rupture de la myéline. Cela peut être pour soutenir les propriétés de conduction optimisées de l’axone sous-jacent. Auer et al. (2018) ont observé des axones faiblement myélinisés chez le poisson zèbre larvaire, comme cela a été précédemment identifié dans le cortex des rongeurs. De manière intéressante, ils ont constaté que lors de l’ablation de gaines uniques sur ces axones faiblement myélinisés, une nouvelle gaine se formait pratiquement au même endroit que la gaine ablatée, même le long d’un tronçon de l’axone autrement non myélinisé (figure 2B). Ainsi, les schémas de myélinisation le long des axones faiblement myélinisés semblent également être maintenus de manière stable chez le poisson zèbre, comme le suggèrent Hill et al. (2018) chez les rongeurs. La fonction des profils de myélinisation clairsemée reste inconnue. De tels modèles peuvent permettre un réglage fin plus dynamique de la fonction d’un seul axone au fil du temps, bien qu’il soit également possible que ces lacunes non myélinisées facilitent la myélinisation progressive pour maintenir des temps de conduction cohérents dans les circuits, à mesure que l’animal grandit et/ou que la longueur des axones change.
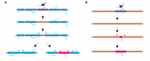
FIGURE 2. Le remodelage de la myéline peut se produire in vivo. (A) L’ablation de gaines uniques sur un axone entièrement myélinisé peut induire la croissance rapide des gaines voisines pour couvrir l’espace. Cet espace peut être entièrement couvert par les gaines voisines, ou le profil de myélinisation original peut être restauré par l’ajout d’une nouvelle gaine. (B) L’ablation d’une gaine sur un axone faiblement myélinisé est suivie de la formation d’une nouvelle gaine de myéline de taille et d’emplacement identiques à la gaine précédente ablatée. Résumé des données d’Auer et al. (2018).
Les gaines de myéline stables chez les mammifères ont-elles aussi cette capacité à se remodeler lorsque le schéma de myélinisation est perturbé ? D’autres études longitudinales couplées à une démyélinisation sont nécessaires pour répondre à cette question. Il est possible que ce remodelage ne soit pas induit par l’activité neuronale mais qu’il s’agisse d’un mécanisme compensatoire de la perte de myéline. La perte d’oligodendrocytes associée à l’âge pourrait déclencher le remodelage des gaines survivantes pour couvrir les portions dénudées de l’axone et contribuer ainsi à maintenir la fonction du circuit. L’imagerie en direct des gaines de myéline dans la vieillesse pourrait déterminer si c’est le cas.
Les études d’imagerie en direct discutées ici ont toutes évalué la dynamique de la longueur de la gaine de myéline, mais pas son épaisseur. L’épaisseur de la gaine peut-elle être régulée dynamiquement ? La stimulation de la signalisation PI3K/AKT/mTOR dans les oligodendrocytes de souris adultes déclenche un enveloppement supplémentaire de la myéline pour augmenter l’épaisseur de la gaine (Snaidero et al., 2014). Cela peut être modulé par l’activité du circuit, car la stimulation neuronale entraîne une augmentation de l’épaisseur de la gaine chez les souris juvéniles et adultes (Gibson et al., 2014 ; Mitew et al., 2018). Cela souligne la nécessité d’imager tous les paramètres de la gaine de manière longitudinale pour comprendre pleinement la dynamique du remodelage de la gaine. Il existe un besoin de modalités d’imagerie en direct pour mesurer précisément l’épaisseur de la gaine le long des axones, car actuellement, cela nécessite une mesure en coupe transversale via la microscopie électronique, ce qui limite l’analyse à un seul point temporel. Certaines techniques d’imagerie sans marquage, comme la microscopie à génération de troisième harmonique et la réflectométrie spectrale, sont prometteuses pour effectuer de telles mesures (Lim et al., 2014 ; Kwon et al., 2017). Le couplage de ces techniques avec des études longitudinales du cortex des rongeurs pourrait déterminer si les gaines de myéline établies peuvent ajuster leur épaisseur, ou si l’activité neuronale pousse simplement la myélinisation de novo à produire des gaines plus épaisses.
Il semble donc que, bien que les gaines de myéline soient capables de se remodeler lorsque la myéline est perturbée, la plupart des gaines sont généralement stables en longueur. Cette stabilité est potentiellement due au maintien de schémas de myélinisation établis précocement et optimisés pour le fonctionnement des circuits.
L’avenir
Des études récentes d’imagerie chez les mammifères se sont concentrées sur la myélinisation de novo et le remodelage des gaines dans la substance grise corticale. Les circuits corticaux reçoivent et envoient des informations via de nombreuses régions, telles que la moelle épinière et le corps calleux, et donc les changements de myéline dans plusieurs zones différentes du SNC pourraient modifier la signalisation dans un seul circuit. Le SNC est traditionnellement décrit par son aspect après fixation au formaldéhyde, où la « matière blanche » décrit les trajets axonaux fortement myélinisés, tandis que la « matière grise » décrit les régions densément peuplées de corps cellulaires neuronaux, de dendrites et de synapses. Cependant, cette classification est trop simpliste ; les CPO produisent des oligodendrocytes myélinisants dans la matière grise et la matière blanche (Dawson et al., 2003), et en fait, il existe de nouvelles preuves de la diversité de la lignée oligodendrogliale et des schémas de myélinisation dans la matière grise et la matière blanche (Rivers et al., 2008 ; Viganò et al., 2013 ; Young et al., 2013 ; Bechler et al., 2015). Cette diversité peut refléter les exigences uniques de la myéline dans des zones distinctes, et potentiellement sur des circuits distincts, du SNC. D’autres études d’imagerie longitudinale sont nécessaires pour mieux comprendre la dynamique de la myélinisation de novo et du remodelage de la gaine dans des zones du SNC au-delà du cortex.
Alors que la transparence optique du poisson zèbre larvaire se prête à une imagerie en direct non invasive, la réalisation de telles expériences dans le SNC des mammifères est plus invasive et techniquement difficile. Hill et al. (2018) et Hughes et al. (2018) ont utilisé la microscopie à deux photons avec des fenêtres d’imagerie crânienne pour imager des profondeurs allant jusqu’à 400 μm dans le cortex. Des techniques similaires pourraient être utilisées pour imager les trajets myélinisés superficiels dans la moelle épinière au fil du temps (Locatelli et al., 2018), mais les régions plus profondes du SNC ne peuvent pas être pénétrées par la seule microscopie à deux photons. Une alternative consiste à utiliser la microendoscopie à deux photons, où une sonde de microendoscope avec une lentille à gradient d’indice de réfraction (GRIN) est insérée dans le tissu pour imager les cellules plus profondément dans le cerveau . Cependant, l’insertion de l’endoscope peut entraîner des réponses inflammatoires qui pourraient avoir un impact sur la myélinisation. Une alternative pourrait être la microscopie à trois photons utilisant la méthode de la fenêtre d’imagerie crânienne, qui a également été utilisée précédemment pour imager l’hippocampe (Horton et al., 2013 ; Ouzounov et al., 2017). La microscopie à trois photons donne un rapport signal sur fond nettement supérieur à celui de la microscopie à deux photons et peut donc être utilisée pour imager des structures tissulaires plus profondes.
Il est particulièrement important de prendre en compte non seulement les différentes régions du SNC, mais aussi les différents neurones au sein de ces régions. Des recherches antérieures suggèrent qu’il existe des différences mécanistiques dans la façon dont des sous-types de neurones distincts régulent leur myélinisation (Koudelka et al., 2016). En outre, il peut y avoir une diversité dans la régulation locale de la myéline. Il est essentiel de se rappeler que les différentes parties du SNC ne sont pas des entités distinctes mais sont interconnectées. L’intégration de la connectomique à méso-échelle, qui se concentre sur la compréhension des connexions de différents sous-types de neurones à travers différentes régions (Zeng, 2018), sera cruciale pour comprendre comment la dynamique de la myélinisation à vie varie entre différents circuits.
Quelle est la conséquence fonctionnelle de la régulation de la myéline le long de circuits distincts ? Jusqu’à présent, les implications fonctionnelles ne peuvent être déduites que par des corrélations avec le comportement. En définitive, il est nécessaire de coupler la mesure de la dynamique de la myéline avec une évaluation directe de l’activité des circuits. Cela nécessitera l’enregistrement de l’activité neuronale au cours d’études longitudinales de la myélinisation afin de relier directement la myélinisation de novo ou le remodelage de la gaine observés aux changements de la fonction du circuit dans le temps. Il sera important de mesurer la dynamique de la myéline et l’activité électrophysiologique des neurones et des axones individuels afin de déterminer comment les modifications des différents paramètres de la gaine de myéline affectent réellement les propriétés de conduction au niveau de la cellule unique, ainsi que d’évaluer l’activité au niveau de la population. Des outils tels que les indicateurs de Ca2+ ou de tension codés génétiquement permettent un enregistrement relativement non invasif de l’activité des circuits, et peuvent même être utilisés pour évaluer l’activité des circuits du cerveau entier (Ahrens et al., 2012 ; Lovett-Barron et al., 2017).
Conclusion
La myélinisation des axones représente un puissant mécanisme potentiel pour réguler la fonction des circuits tout au long de la vie. La recherche a démontré que la myélinisation de novo dans le cortex (via la production de nouveaux oligodendrocytes) se produit même à l’âge adulte, et qu’elle peut être améliorée en stimulant l’activité du circuit. Une fois la myéline formée, elle est stable, avec un faible renouvellement des oligodendrocytes et un remodelage limité de la longueur des gaines de myéline existantes. Toutefois, ces structures stables peuvent conserver la capacité de se remodeler si la myéline est perturbée. Cela a des implications intéressantes concernant la plasticité de la myéline dans le maintien de la fonction des circuits au cours des blessures, des maladies et de la vieillesse. Il reste à savoir précisément comment les modifications de la myélinisation affectent la fonction du circuit sous-jacent. En fin de compte, une approche au niveau du circuit, intégrant l’analyse de la dynamique de la myéline avec la mesure directe de la fonction du circuit, est nécessaire pour apprécier pleinement la façon dont la myélinisation dynamique influence la fonction globale du système nerveux tout au long de la vie.
Contributions des auteurs
Tous les auteurs énumérés ont apporté une contribution substantielle, directe et intellectuelle au travail, et ont approuvé sa publication.
Financement
DAL est soutenu par une bourse de recherche senior du Wellcome Trust (102836/Z/13/Z). JMW est soutenu par un Ph.D. de l’Université d’Edimbourg Tissue Repair Studentship Award (MRC Doctoral Training Partnership MR/K501293/1) et le Wellcome Trust Four-Year Ph.D. Program in Tissue Repair (Grant 108906/Z/15/Z).
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Dynamique neuronale à l’échelle du cerveau pendant l’adaptation motrice chez le poisson zèbre. Nature 485, 471-477. doi : 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., et Lyons, D. A. (2017). Sur la plasticité des axones myélinisés et la formation et la fonction des circuits neuronaux. J. Neurosci. 37, 10023-10034. doi : 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K., and Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi : 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., et Czopka, T. (2018). Preuve du remodelage de la gaine de myéline dans le SNC révélé par l’imagerie in vivo. Curr. Biol. 28, 549-559. doi : 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Cell death and control of cell survival in the oligodendrocyte lineage. Cell 70, 31-46. doi : 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015). La longueur de la gaine de myéline du SNC est une propriété intrinsèque des oligodendrocytes. Curr. Biol. 25, 2411-2416. doi : 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., et Trapp, B. D. (2000). Cellules progénitrices oligodendrocytes NG2-positives dans le cerveau humain adulte et les lésions de la sclérose en plaques. J. Neurosci. 20, 6404-6412. doi : 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Vieillissement et structure de la matière blanche du cerveau chez 3 513 participants de la UK Biobank. Nat. Commun. 7:13629. doi : 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., et Lyons, D. A. (2013). Les oligodendrocytes individuels ne disposent que de quelques heures pour générer de nouvelles gaines de myéline in vivo. Dev. Cell 25, 599-609. doi : 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., and Reynolds, R. (2003). Cellules progénitrices gliales exprimant NG2 : une population abondante et répandue de cellules cycliques dans le SNC du rat adulte. Mol. Cell. Neurosci. 24, 476-488. doi : 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). L’expression de BCAS1 définit une population d’oligodendrocytes myélinisants précoces dans les lésions de sclérose en plaques. Sci. Transl. Med. 9:eaam7816. doi : 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Un nouveau mécanisme de plasticité du système nerveux : la myélinisation dépendante de l’activité. Nat. Rev. Neurosci. 16, 756-767. doi : 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Réglage des propriétés du nœud de Ranvier et de l’internœud dans les axones myélinisés pour ajuster la synchronisation du potentiel d’action. Nat. Commun. 6:8073. doi : 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). L’activité neuronale favorise l’oligodendrogenèse et la myélinisation adaptative dans le cerveau des mammifères. Science 344:1252304. doi : 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., et Grutzendler, J. (2018). Plasticité de la myéline corticale tout au long de la vie et dégénérescence liée à l’âge dans le cerveau vivant des mammifères. Nat. Neurosci. 21, 683-695. doi : 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., et Nishiyama, A. (2014). Modulation de la génération d’oligodendrocytes pendant une fenêtre temporelle critique après la division des cellules NG2. Nat. Neurosci. 17, 1518-1527. doi : 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. (2013). Microscopie in vivo à trois photons des structures sous-corticales dans un cerveau de souris intact. Nat. Photonics 7, 205-209. doi : 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). La huntingtine mutante dérègle l’expression du gène de la myéline médiée par le facteur de régulation de la myéline et affecte les oligodendrocytes matures. Neuron 85, 1212-1226. doi : 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M., et Bergles, D. E. (2013). Les progéniteurs oligodendrocytes équilibrent la croissance avec l’autorépulsion pour atteindre l’homéostasie dans le cerveau adulte. Nat. Neurosci. 16, 668-676. doi : 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., et Bergles, D. E. (2018). Remodelage de la myéline par l’oligodendrogenèse dépendante de l’expérience dans le cortex somatosensoriel adulte. Nat. Neurosci. 21, 696-706. doi : 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., et Schnitzer, M. J. (2004). In vivo mammalian brain imaging using one- and two-photon fluorescence microendoscopy. J. Neurophysiol. 92, 3121-3133. doi : 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). Degeneration and impaired regeneration of gray matter oligodendrocytes in amyotrophic lateral sclerosis. Nat. Neurosci. 16, 571-579. doi : 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Les sous-types neuronaux individuels présentent une diversité dans la myélinisation du SNC médiée par la libération de vésicules synaptiques. Curr. Biol. 26, 1447-1455. doi : 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). La signalisation par les récepteurs AMPA sur les précurseurs d’oligodendrocytes favorise la myélinisation en améliorant la survie des oligodendrocytes. eLife 6:e28080. doi : 10.7554/eLife.28080.
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Métrologie optique à l’échelle nanométrique sans étiquette sur les axones myélinisés in vivo. Nat. Commun. 8:1832. doi : 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., et Webb, W. W. (2004). In vivo multiphoton microscopy of deep brain tissue. J. Neurophysiol. 91, 1908-1912. doi : 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., et Melendez-Vasquez, C. V. (2014). Imagerie sans étiquette de la myélinisation des cellules de Schwann par microscopie à génération de troisième harmonique. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi : 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Les phagocytes mononucléaires spécifient et adaptent localement leur phénotype dans un modèle de sclérose en plaques. Nat. Neurosci. 21, 1196-1208. doi : 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Circuits ancestraux pour la modulation coordonnée de l’état du cerveau. Cell 171, 1411-1423. doi : 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., et Rockel, C. (2006). La croissance de la matière blanche comme mécanisme de développement cognitif chez l’enfant. Neuroimage 33, 936-946. doi : 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). L’apprentissage des habiletés motrices nécessite une myélinisation centrale active. Science 346, 318-322. doi : 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). La stimulation pharmacogénétique de l’activité neuronale augmente la myélinisation d’une manière spécifique à l’axone. Nat. Commun. 9:306. doi : 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., et Monje, M. (2017). Enveloppé pour s’adapter : myélinisation dépendante de l’expérience. Neuron 95, 743-756. doi : 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). Imagerie in vivo à trois photons de l’activité des neurones marqués au GCaMP6 dans la profondeur du cerveau intact de la souris. Nat. Methods 14, 388-390. doi : 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Changements couplés dans la microstructure de la matière blanche du cerveau et l’intelligence fluide à un âge avancé. J. Neurosci. 35, 8672-8682. doi : 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). PDGFRA/NG2 glia generate myelinating oligodendrocytes and piriform projection neurons in adult mice. Nat. Neurosci. 11, 1392-1401. doi : 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). L’apprentissage des habiletés motrices induit des changements dans la microstructure de la matière blanche et la myélinisation. J. Neurosci. 33, 19499-19503. doi : 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). Relations entre la maturation de la matière blanche et le temps de réaction dans l’enfance. J. Int. Neurophsychol. Soc. 20, 99-112. doi : 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., et Grutzendler, J. (2014). Imagerie in vivo sans étiquette des axones myélinisés dans la santé et la maladie avec la microscopie confocale à réflectance spectrale. Nat. Med. 20, 443-449. doi : 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., et Johansen-berg, H. (2009). Training induces changes in white-matter architecture. Nat. Neurosci. 12, 1370-1371. doi : 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). Enveloppement de la membrane de myéline des axones du SNC par une croissance polarisée dépendante de PI(3,4,5)P3 au niveau de la langue interne. Cell 156, 277-290. doi : 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., et Buxbaum, J. D. (2011). Lier le dysfonctionnement des oligodendrocytes et de la myéline aux anomalies du neurocircuit dans la schizophrénie. Prog. Neurobiol. 93, 13-24. doi : 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. (2014). Profils distincts de distribution de la myéline le long des axones uniques des neurones pyramidaux dans le néocortex. Science 344, 319-324. doi : 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., et Richardson, W. D. (2017). Stabilité remarquable des oligodendrocytes myélinisants chez la souris. Cell Rep. 21, 316-323. doi : 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., et Dimou, L. (2013). La transplantation révèle des différences régionales dans la différenciation des oligodendrocytes dans le cerveau adulte. Nat. Neurosci. 16, 1370-1372. doi : 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., and Barres, B. A. (2008). Des étapes distinctes de la myélinisation régulées par la gamma-sécrétase et les astrocytes dans un système de coculture du SNC à myélinisation rapide. Neuron 60, 555-569. doi : 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Déterminants de la vitesse de conduction dans les fibres nerveuses myélinisées. Muscle Nerve 3, 141-150. doi : 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). La production rapide de nouveaux oligodendrocytes est nécessaire dans les premières étapes de l’apprentissage des habiletés motrices. Nat. Neurosci. 19, 1210-1217. doi : 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Dynamique de la génération d’oligodendrocytes et de la myélinisation dans le cerveau humain. Cell 159, 766-774. doi : 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Dynamique des oligodendrocytes dans le SNC adulte sain : preuve du remodelage de la myéline. Neuron 77, 873-885. doi : 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). La connectomique à méso-échelle. Curr. Opin. Neurobiol. 50, 154-162. doi : 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar
.