- Trióxido de azufre Propiedades químicas,Usos,Producción
- Propiedades químicas
- Propiedades físicas
- Usos
- Métodos de producción
- Descripción general
- Aire &Reacciones con el agua
- Perfil de reactividad
- Peligro
- Peligro para la salud
- Peligro de incendio
- Perfil de seguridad
- Exposición potencial
- almacenamiento
- Envío
- Incompatibilidades
- Eliminación de residuos
Trióxido de azufre Propiedades químicas,Usos,Producción
Propiedades químicas
El trióxido de azufre, S03, también conocido como anhídrido sulfúrico, agujas o polímero, existe en un número de modificaciones que difieren en especies moleculares y forma cristalina. Tiene una modificación blanca, parecida al hielo, que se funde a 16°C (61°F) y otras dos formas parecidas a los bestos que se funden a temperaturas más altas de 33 y 62°C (90 y 144 °F). La forma líquida o gaseosa incolora tiene humos irritantes y tóxicos y hierve a 45 °C (112 °F).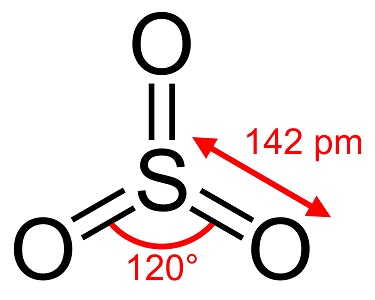
El trióxido de azufre es una sustancia altamente reactiva, un fuerte agente oxidante y un peligro de incendio. Reacciona con los óxidos metálicos para formar sulfatos y con el agua para formar ácido sulfúrico. El trióxido de azufre se utiliza para la sulfonación.
Propiedades físicas
Líquido incoloro a temperatura ambiente y presión atmosférica; humos en el aire.
El trióxido de azufre tiende a polimerizar, especialmente en presencia de trazas de agua o ácido sulfúrico. Sin embargo, la velocidad de su polimerización disminuye enormemente a medida que se acerca su punto de congelación. El trióxido de azufre sólido (polimérico) existe en tres fases polimórficas: modificaciones alfa, beta y gamma.
La fase alfa está formada por agujas parecidas al hielo que tienen una estructura polimérica reticulada. Se funde a 62,3°C y tiene una presión de vapor de 73 torr a 25°C.
La fase beta es un alótropo metaestable con agujas blancas, parecidas a las del amianto, formadas por moléculas poliméricas, que se funde a 32,5°C y tiene una presión de vapor de 344 torr a 25°C.
La modificación gamma a temperaturas ordinarias puede existir en forma sólida o líquida. En forma sólida es una masa coloidal parecida al hielo que se funde a 16,8°C. En forma líquida tiene una densidad de 1,9224 g/mL, hirviendo a 44,8°C. Tiene una presión de vapor de 433 torr a 25°C. La fase gamma está formada por moléculas de trímero cíclico y monómero. Cuando el trióxido de azufre sólido se funde, se convierte en su fase gamma, que al solidificarse cambia a la modificación alfa.
La temperatura crítica del SO3 es de 217,8°C; la presión crítica de 80,97 atm; la densidad crítica de 0,63 g/cm3; la constante dieléctrica del SO3 líquido a 18°C es de 3,11.
El trióxido de azufre se disuelve en agua formando ácido sulfúrico y generando gran calor.
Usos
El trióxido de azufre se utiliza como intermedio en la fabricación de ácido sulfúrico y óleum para la sulfonación, en particular, de tintes y colorantes, y para la producción de ácido nítrico anhidro y explosivos. El trióxido de azufre sólido se comercializa bajo los nombres de Sulphan y Triosul, y se utiliza principalmente para la sulfonación de ácidos orgánicos. El tetrafluoruro de azufre es un agente fluorante. El hexafluoruro de azufre sirve como aislante gaseoso en instalaciones eléctricas de alta tensión. El fluoruro de sulfuro se utiliza como insecticida y fumigante.
Sulfonación de compuestos orgánicos, especialmente detergentes no iónicos, colectores de energía solar. Suele generarse en la planta donde se va a utilizar.
Métodos de producción
El trióxido de azufre se produce como intermedio en la fabricación de ácido sulfúrico por el proceso de contacto (Ver Ácido sulfúrico). El proceso implica la oxidación catalítica del dióxido de azufre a trióxido.
El trióxido de azufre se prepara en el laboratorio calentando el ácido sulfúrico fumante, condensando sus vapores y recogiéndolos en un receptor frío. Cuando los vapores se condensan por debajo de 27°C en presencia de trazas de humedad, se producen las tres fases polimórficas del SO3. Pueden separarse por destilación fraccionada. La condensación de los vapores por encima de 27°C forma la variedad líquida del trióxido de azufre gamma.
Descripción general
El trióxido de azufre es un sólido cristalino entre incoloro y blanco que se evapora en el aire. A menudo se envía con un inhibidor para evitar la polimerización. El trióxido de azufre reacciona violentamente con el agua para formar ácido sulfúrico con la liberación de calor. El trióxido de azufre es corrosivo para los metales y los tejidos. El trióxido de azufre provoca quemaduras en los ojos y en la piel. Su ingestión provoca graves quemaduras en la boca, el esófago y el estómago. El vapor es muy tóxico por inhalación. El trióxido de azufre es un riesgo de incendio cuando entra en contacto con materiales orgánicos como madera, algodón, tableros de fibra, etc.
Aire &Reacciones con el agua
Se combina con el agua con fuerza explosiva, formando ácido sulfúrico debido a su acidez El trióxido de azufre carboniza la mayoría de las sustancias orgánicas. Al exponerse al aire el trióxido de azufre absorbe rápidamente la humedad, emitiendo densos humos blancos .
Perfil de reactividad
La reacción del trióxido de azufre y el difluoruro de oxígeno es muy vigorosa y se producen explosiones si la reacción se lleva a cabo en ausencia de un disolvente . La reacción de trióxido de azufre en exceso con tetrafluoroetileno provoca una descomposición explosiva a fluoruro de carbonilo y dióxido de azufre . La reacción del ácido perclórico anhidro con el trióxido de azufre es violenta y va acompañada de la evolución de un calor considerable (Pascal 16:300 1931-34). El trióxido de azufre líquido reacciona violentamente con el cloruro de nitrilo, incluso a 75° C. La reacción del trióxido de azufre y el óxido de plomo provoca una luminiscencia blanca . La combinación de yodo, piridina, trióxido de azufre y formamida desarrolló una sobrepresurización de gas después de varios meses. Esto se debe a la lenta formación de ácido sulfúrico, a partir del agua externa o de la deshidratación de la formamida a cianuro de hidrógeno.
Peligro
Agente oxidante, riesgo de incendio en contacto con materiales orgánicos, se produce un aumento explosivo de la presión de vapor cuando se funde la forma α. El anhídrido se combina con el agua, formando ácido sulfúrico y desarrollando calor. Altamente tóxico, fuerte irritante para los tejidos.
Peligro para la salud
El trióxido de azufre es altamente tóxico. Es irritante y corrosivo para las membranas mucosas. Es venenoso si se inhala o se ingiere. El contacto provoca quemaduras graves en la piel y los ojos.
Peligro de incendio
Riesgo de incendio en contacto con materiales orgánicos. Se produce un aumento explosivo de la presión de vapor cuando se funde la forma alfa. Se combina con el agua con violencia explosiva, formando ácido sulfúrico. Puede encender otros materiales combustibles (madera, papel, aceite, etc.). Los gases venenosos e inflamables pueden acumularse en tanques y vagones tolva. El vertido al alcantarillado puede crear peligro de incendio o explosión. Forma ácido sulfúrico en contacto con el agua. Evitar el agua y los materiales orgánicos. Al exponerse al aire, el trióxido de azufre absorbe la humedad y emite densos humos blancos.
Perfil de seguridad
Veneno por inhalación. Efectos sistémicos humanos por inhalación: tos y otros cambios pulmonares y olfativos. Es un irritante corrosivo para la piel, los ojos y las membranas mucosas. Reacción violenta con O2F2, PbO, NClO2, HClO4, P, tetrafluoretileno, acetonitrilo, ácido sulfúrico, dimetilsulfóxido, dioxan, agua, difenilmercurio, formamida, yodo, piridina, óxidos metálicos. Reacciona con el vapor para formar vapores corrosivos y tóxicos de ácido sulfúrico. Cuando se calienta hasta su descomposición emite humos tóxicos de SO,. Véase también ÁCIDO SULFÚRICO.
Exposición potencial
El trióxido de azufre se utiliza como agente sulfatante y sulfonante para detergentes, aditivos para aceites lubricantes y otros compuestos orgánicos; en colectores de energía solar. También se utiliza como intermedio en la fabricación de ácido sulfúrico y en la fabricación de explosivos.
almacenamiento
La presión de vapor del trióxido de azufre aumenta rápidamente con el aumento de la temperatura y, cuando la forma α se funde, el aumento de la presión es explosivo; en consecuencia, los contenedores de transporte y almacenamiento deben soportar presiones de 10 a 15 atm. El trióxido de azufre reacciona vigorosa y altamente exotérmicamente con el agua para producir ácido hidrosulfúrico. Cuando se expone al aire húmedo, emite vapores y forma una niebla de ácido sulfúrico que acaba llenando todo el espacio disponible; también corroe los metales. Es un potente agente oxidante y, en fase líquida, carboniza los materiales orgánicos.
Envío
UN1829 Trióxido de azufre, estabilizado, Clase de peligro: 8; Etiquetas: 8-Material corrosivo, 6.1-Peligro de inhalación tóxica, Zona de peligro de inhalación B.
Incompatibilidades
Combustible y corrosivo. Es un fuerte oxidante. Reacciona violentamente con el agua, el vapor o la humedad, liberando ácido hidrosulfúrico corrosivo. Se producen reacciones violentas en contacto con bases fuertes; ácidos fuertes, metales químicamente activos; agentes reductores; metales finamente divididos; cianuros, nitratos, picratos, fulminatos, cloratos, sulfuros, carburos, fósforo, difluoruro de dióxido, óxido de bario; óxido de plomo; difenilmercurio; alcoholes, cloruro de nitrilo; acetonitrilo, dioxano, tetrafluoroetileno.
Eliminación de residuos
Devolver las bombonas de gas comprimido recargables al proveedor. Los cilindros no recargables deben desecharse de acuerdo con las regulaciones locales, estatales y federales. Deje que el gas restante se ventile lentamente a la atmósfera en un área no confinada o en una campana de extracción. Los cilindros recargables deben devolverse al proveedor original con las tapas de las válvulas y los tapones de salida asegurados y las tapas de protección de las válvulas en su lugar.