¿Te has preguntado alguna vez por qué las barritas luminosas (ver fig. 1) brillan después de haberlas doblado? ¿O por qué esas estrellas de plástico siguen brillando por la noche después de apagar las luces? Puede que no lo hayas hecho. Sin embargo, tanto si te has hecho esas preguntas como si no, es de esperar que el siguiente texto te proporcione respuestas y explicaciones sobre los fenómenos de las pulseras luminosas, las medusas brillantes, la luz negra y muchos más.

Figura 1. Palos luminosos.
Luminiscencia
En general, el resplandor que se produce en todos los fenómenos mencionados se llama luminiscencia. La luminiscencia es la energía liberada por una sustancia en forma de luz . Se pueden diferenciar varios tipos de luminiscencia:
- Un ejemplo es la quimioluminiscencia. Durante algunas reacciones químicas, la energía se libera en forma de luz. Esto ocurre después de doblar un palo luminoso. También es la razón por la que brillan animales como las medusas o algunos microorganismos. En este caso, se llama bioluminiscencia.
- Otro tipo es la triboluminiscencia. Se puede observar cuando se abre un sobre autoadhesivo en completa oscuridad o cuando se desenrolla una cinta adhesiva en una habitación oscura. Al hacerlo, la energía mecánica se introduce en el sistema y sirve como activador del brillo.
- Probablemente el tipo de luminiscencia más conocido es la fotoluminiscencia. Aquí, la energía es proporcionada por la radiación electromagnética, por ejemplo a través de la luz solar o una lámpara ultravioleta, como en algunas discotecas. Esto provoca fenómenos como el resplandor continuo de las estrellas de plástico o el brillo extremo de la ropa blanca bajo la luz negra. Se puede diferenciar la fluorescencia y la fosforescencia, que se explicará a continuación.
¿Qué es un estado de excitación electrónica?
En general, todos los tipos de luminiscencia se basan en los llamados procesos fotofísicos. Normalmente, las propias moléculas se describen como fluorescentes. Este es el caso de los colorantes fluorescentes como la fluoresceína o la curcumina . Sin embargo, para explicar los procesos fotofísicos, hay que mirar más de cerca a un nivel aún más pequeño que el molecular.
Los átomos de los diferentes elementos tienen un número diferente de electrones distribuidos en varias capas y orbitales. Los electrones son un tipo de partícula elemental. Las transiciones electrónicas son responsables de la luminiscencia . Cuando el sistema absorbe energía, los electrones se excitan y pasan a un estado energético superior. Antes de la excitación, en el estado básico, algunos de los electrones se encuentran en el llamado HOMO (Highest Occupied Molecular Orbital). Después de alcanzar el estado de excitación, se encuentran en el LUMO (Orbital Molecular Más Bajo Desocupado) (véase la Fig. 2). Cómo funciona esto exactamente se explicará utilizando la fotoluminiscencia como ejemplo específico.

Figura 2. Excitación electrónica.
Los diferentes estados energéticos de un átomo o molécula se conocen como «niveles de energía». Dependiendo de la molécula y del átomo, los electrones sólo pueden ocupar niveles de energía discretos ya que la energía está cuantizada, lo que significa, que la energía sólo puede ser absorbida y emitida en determinadas cantidades . La diferencia entre dos niveles se puede calcular con la ecuación 1 (donde E2 es el nivel de energía más alto y E1 el más bajo).
(1) ΔE = E2-E1
Los fotones, partículas de las que se compone la radiación electromagnética o la luz, tienen que tener un determinado valor energético para poder excitar a los electrones. La energía de un fotón se puede calcular con la ecuación 2, donde h es la constante de Planck y ν es la frecuencia de la luz.
(2) Ephoton = hν
La energía de excitación necesaria para los electrones es igual a la diferencia entre los niveles de energía. Sólo la luz con una determinada energía, y en consecuencia con una determinada frecuencia y longitud de onda, es capaz de excitar a los electrones . Igualando las ecuaciones 1 y 2, y con la ayuda de la ecuación 3 (donde c representa la velocidad de la luz), se puede calcular la frecuencia y la longitud de onda necesarias (véase la ecuación 4) . En muchos casos, se utiliza la radiación UV para la excitación.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Desactivación de estados electrónicamente excitados
Estos estados electrónicamente excitados son inestables. Los electrones vuelven a sus estados básicos. Al mismo tiempo, la energía de excitación se libera de nuevo. Se distingue entre procesos de desintegración radiativa y no radiativa. La mayor parte de las veces, la desintegración es no radiativa, por ejemplo, a través de la relajación vibracional, el enfriamiento con las moléculas circundantes o la conversión interna (CI). Estos procesos se explicaran en detalle mas adelante.
A veces, un decaimiento radiativo puede ocurrir en forma de fluorescencia y fosforescencia. La energía se emite como radiación electromagnética o fotones. La luz emitida tiene una mayor longitud de onda y una menor energía que la luz absorbida porque una parte de la energía ya ha sido liberada en un proceso de desintegración no radiativa. Esta es la razón por la que se puede conseguir una emisión en el espectro visible mediante la excitación con radiación UV no visible. Este desplazamiento hacia una mayor longitud de onda se denomina desplazamiento de Stokes.
Comparación: Fluorescencia vs. Fosforescencia
Tanto la fluorescencia como la fosforescencia son emisiones espontáneas de radiación electromagnética. La diferencia es que el resplandor de la fluorescencia se detiene justo después de que se apague la fuente de radiación excitadora, mientras que en el caso de la fosforescencia, puede producirse un resplandor posterior con duraciones de fracciones de segundo hasta horas.
Para comparar los procesos fotofísicos que hay detrás de ambos fenómenos, hay algunos datos sobre los electrones que son útiles para su comprensión: Los electrones son partículas que tienen el llamado espín y un número cuántico de espín. Éste puede tener dos valores diferentes, a saber, +1/2 o -1/2 . Este número es una propiedad que en realidad no podemos imaginar ni describir fácilmente. A menudo se compara con una peonza que gira en el sentido de las agujas del reloj o en sentido contrario. Sin embargo, esta descripción no es ni matemática ni físicamente correcta. Dos electrones en un solo orbital de un átomo tienen espín antiparalelo, que se anota como (↓) .
Fluorescencia
En el diagrama de Jablonski para la fluorescencia (véase la Fig. 3), el estado de espín singlete S0 es el estado básico de los electrones, y S1 y S2 son estados excitados singlete (los estados sólo se utilizan como ejemplo en este texto y no se aplican necesariamente a determinados átomos, moléculas, etc.). Dentro de esos estados, hay varios niveles de energía. Cuanto más alto es el nivel, más energía posee un electrón cuando está en ese nivel. En el caso de los estados singlete, los electrones tienen espines antiparalelos.

Figura 3. Diagrama de Jablonski para la fluorescencia.
Los electrones se elevan desde el estado básico S0, por ejemplo, a un nivel de energía del segundo estado excitado S2, cuando son excitados por la radiación electromagnética. Una vez finalizada la excitación, los electrones sólo permanecen en ese estado de excitación durante un breve período de tiempo (aprox. 10-15 s) y, a continuación, comienzan a descender inmediatamente al estado básico . Al hacerlo, la energía puede liberarse inicialmente a los alrededores mediante la relajación vibracional. Esto significa que la energía térmica se libera por el movimiento del átomo o molécula hasta que se alcanza el nivel más bajo del segundo estado de excitación.
La mayor brecha entre el segundo y el primer estado de excitación se supera por conversión interna. Esto describe una transición electrónica entre dos estados mientras se mantiene el espín de los electrones. Ahora, los electrones pueden relajarse aún más debido a una mayor relajación vibracional hasta que alcanzan el nivel de energía más bajo del estado S1.
Teóricamente, los electrones podrían relajarse aún más de forma no radiativa hasta que finalmente alcancen de nuevo el estado de tierra. Sin embargo, puede darse el caso de que la última cantidad de energía sea demasiado grande para ser liberada a los alrededores porque las moléculas circundantes no pueden absorber tanta energía. Entonces se produce la fluorescencia, que da lugar a una emisión de fotones con una determinada longitud de onda. La emisión sólo dura hasta que los electrones vuelven a estar en el estado básico. Dado que durante todas esas transiciones el espín del electrón se mantiene igual, se describen como de espín permitido.
Fosforescencia
Para la fosforescencia, las cosas son un poco diferentes (ver Fig. 4). Hay de nuevo un estado básico S0 y los dos estados excitados, S1 y S2. Además, hay un estado excitado triplete T1 que se encuentra energéticamente entre el estado S0 y S1. Los electrones vuelven a tener espines antiparalelos en el estado básico.
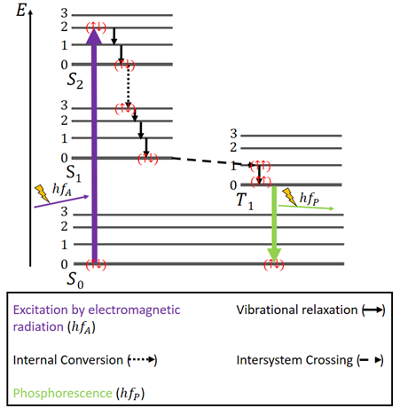
Figura 4. Diagrama de Jablonski para la fosforescencia.
La excitación se produce de la misma manera que en la fluorescencia, es decir, a través de la radiación electromagnética. La liberación de energía a través de la relajación vibracional y la conversión interna mientras se mantiene el mismo espín es la misma aquí también, pero sólo hasta que se alcanza el estado S1.
Al lado de los estados singlete, existe un estado triplete y puede producirse el llamado cruce entre sistemas (ISC) ya que el estado T1 es energéticamente más favorable que el estado S1. Este cruce, al igual que la conversión interna, es una transición electrónica entre dos estados excitados. Pero a diferencia de la conversión interna, el ISC se asocia a una inversión de espín de singlete a triplete. Los electrones en el estado triplete tienen espines paralelos, lo que se observa como () . Este proceso de ISC se describe como «de espín prohibido». No es completamente imposible – debido a un fenómeno llamado «acoplamiento de espín-órbita» – sin embargo, es bastante improbable.
En el estado T1, el decaimiento no radiativo también es posible. Sin embargo, una transición entre el nivel de energía más bajo del estado triplete y el estado S0 no es fácilmente posible, porque esa transición también está prohibida por el espín. Aun así, puede ocurrir de todos modos con una pequeña posibilidad. Provoca una emisión bastante débil de fotones porque el espín del electrón tiene que invertirse de nuevo. La energía queda atrapada en este estado durante un tiempo y sólo puede liberarse lentamente. Despues de que toda la energia ha sido liberada, los electrones estan de vuelta en el estado de tierra.
Conclusion
Los procesos de espin permitidos y prohibidos sirven como explicacion para el brillo que cesa inmediatamente de la fluorescencia y para el brillo posterior de la fosforescencia. La fosforescencia suele producirse sólo con moléculas «más pesadas», ya que el espín tiene que invertirse con la ayuda del acoplamiento de espín y órbita. El hecho de que se emita radiación electromagnética, y con qué longitud de onda, depende de la cantidad de energía que se pueda liberar de antemano por desintegración no radiativa. Tambien depende de las propiedades de los llamados quenchers que rodean a las moleculas y que son capaces de absorber mayores cantidades de energia.
Todos los procesos que pueden llevar a una inhibicion de los decaimientos radiativos pueden causar quenching de fluorescencia. Algunos ejemplos son los procesos de decaimiento no radiativo, pero también la destrucción de la molécula fluorescente . La eficiencia cuántica describe la eficiencia del proceso y se define como la relación entre los fotones absorbidos y los emitidos. Esta propiedad es diferente para cada sustancia.
Aunque este texto se centra en la fotoluminiscencia, los procesos fotofísicos son los mismos para todos los tipos de luminiscencia.
Aplicaciones
Además de productos como las barras luminosas, la fluorescencia y la fosforescencia se utilizan de muchas otras maneras. Otros ejemplos son los postes guía que conducen a una salida de emergencia y que no necesitan suministro eléctrico, pero que brillan por la noche gracias a la fosforescencia. Incluso las plantas pueden hacerse fluorescentes: Las espinacas pueden modificarse con ayuda de la nanotecnología para que puedan detectar rastros de sustancias explosivas en el agua subterránea. Las hojas contienen nanotubos de carbono a los que pueden unirse los nitroaromáticos. Si lo hacen, la planta libera una señal fluorescente que puede detectarse con cámaras de infrarrojos.
El vídeo muestra diferentes tipos de luminiscencia. A la izquierda, muestra la fluorescencia del colorante curcumina, que contiene la especia cúrcuma, bajo luz ultravioleta . La curcumina se disuelve en alcohol para hacer visible la fluorescencia.
La araña de plástico y el compuesto del tubo pequeño son ejemplos de fosforescencia. El aluminato de estroncio, contenido en el tubo, es excitado inicialmente por la radiación UV y acaba emitiendo luz verde. La causa de esto es un dopaje con elementos como el europio, que hace que el compuesto sea utilizable como pigmento luminiscente .
Al doblar la varilla luminosa (en el lado derecho) se inicia una reacción química entre el peróxido de hidrógeno y un colorante y oxalato de fenilo. Se puede observar la quimioluminiscencia.
Video 1. Fluorescencia, fosforescencia y quimioluminiscencia en comparación.
K. Arnold et al., Chemie Oberstufe (en alemán), Cornelsen Schulverlage, Berlín, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (en alemán), spektrum.de. (consultado el 25 de enero de 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (en alemán), chemieunterricht.de 2010. (consultado el 25 de enero de 2017)
Lexikon der Physik: Photophysikalische Prozesse (en alemán), spektrum.de. (consultado el 27 de enero de 2017)
D. Wiechoczek, Chemie mit Curry (en alemán), chemieunterricht.de 2015. (consultado el 27 de enero de 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (en alemán), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (en alemán), chemie.de. (consultado el 27 de enero de 2017)
Relación de frecuencia de Bohr (en alemán), chemgapedia.de. (consultado el 25 de enero de 2017)
Universidad Tecnológica de Ilmenau, Curso Práctico Química Física II: Química Física/Tecnología de la Microrreacción, Experimento de enfriamiento por fluorescencia (en alemán), tu-ilmenau.de. (consultado el 27 de enero de 2017)
Desplazamiento de Stokes (en alemán), chemie.de. (consultado el 25 de enero de 2017)
Espín del electrón (en alemán), chemie.de. (consultado el 27 de enero de 2017)
Rendimiento cuántico (en alemán), chemie.de. (consultado el 27 de enero de 2017)
Las espinacas detectan explosivos en las aguas subterráneas (en alemán), Spiegel Online, 1 de noviembre de 2016. (consultado el 27 de enero de 2017)
D. Weiß, Phosphorescence (en alemán), chemie.uni-jena.de. (consultado el 27 de enero de 2017)
 Kim Dreier es una estudiante del Marianne-Weber-Gymnasium (escuela secundaria) en Lemgo, Alemania.
Kim Dreier es una estudiante del Marianne-Weber-Gymnasium (escuela secundaria) en Lemgo, Alemania.