Propiedades generales de las sales
Algunas de las propiedades características de las sales son:
- Puntos de fusión y ebullición: Las sales son en su mayoría sólidos que se funden así como hierven a altas temperaturas.
- Solubilidad en agua: Las sales son generalmente solubles en agua. Por ejemplo, el cloruro de sodio, el sulfato de potasio, el nitrato de aluminio, el carbonato de amonio, etc., son sales solubles mientras que el cloruro de plata, el cloruro de plomo, el carbonato de cobre, etc., son insolubles en agua.
- Agua de cristalización: Generalmente, las sales se encuentran en forma de cristales con moléculas de agua presentes en ellos. Esta agua se llama agua de cristalización y tales sales se llaman sales hidratadas.
Por ejemplo, el cristal de sulfato de cobre tiene cinco moléculas de agua por cada molécula de sulfato de cobre. Esto se escribe como CuSO4.5H2O. Esta agua de cristalización da al cristal su forma. También da color a algunos cristales. Al calentarse, las sales hidratadas pierden su agua de cristalización y, como resultado, los cristales pierden su forma y color y se convierten en una sustancia pulverulenta.
Las sales hidratadas que han perdido su agua de cristalización se denominan sales anhidras.
Cuando el sulfato de cobre hidratado se calienta, cede moléculas de agua para formar sulfato de cobre anhidro en polvo blanco. Al añadir agua, esta sustancia puede volver a convertirse en una solución de sulfato de cobre hidratado.
También se pregunta
- Clasificación de las sales
- Usos de las diferentes sales en la vida cotidiana
- Preparación de las sales
- Describir la preparación de las sales solubles e insolubles
- Cualitativa Análisis de sales
- Acción del calor sobre las sales
- Prueba de cationes y aniones en soluciones acuosas
- Construir ecuaciones iónicas por el método de variación continua
- ¿Qué es la estequiometría y por qué se utiliza en química?
Propiedades generales de las sales :
1. Reacción con un ácido : Cuando una sal reacciona con un ácido, se forma otra sal y un ácido. Por ejemplo, cuando se calienta cloruro de sodio con ácido sulfúrico, se produce hidrogensulfato de sodio (a baja temperatura) y luego sulfato de sodio (a alta temperatura) y se desprende gas cloruro de hidrógeno.
2. Reacción con una base : Una sal reacciona con una base para producir otra sal y una base.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reacción con un metal : A veces, una solución salina puede reaccionar con un metal. Por ejemplo, cuando se sumerge un clavo de hierro en una solución acuosa de sulfato de cobre, el cobre se deposita en la superficie del clavo y el sulfato ferroso formado permanece en la solución.
CuSO4 + Fe → FeSO4 + Cu
Esta reacción demuestra que el hierro es más reactivo que el cobre.
Así, un metal más reactivo puede desplazar a un metal menos reactivo de una solución de su sal.
4. Comportamiento de las sales frente al agua :
Cuando una sal se disuelve en agua, la solución puede ser neutra, ácida o alcalina. Esto depende de la naturaleza de la sal utilizada.
(i) Una sal normal derivada de un ácido fuerte y una base fuerte da una solución neutra. Por ejemplo, las soluciones acuosas de NaCl y K2SO4 son neutras al tornasol.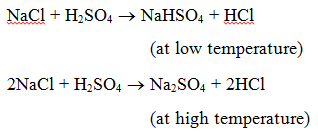
(ii) Una sal normal derivada de un ácido débil y una base fuerte da una solución alcalina. Por ejemplo, las soluciones acuosas tanto del carbonato de sodio (Na2CO3) como del acetato de sodio (CH3COONa) son alcalinas.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Una sal derivada de un ácido fuerte y una base débil da una solución ácida. Por ejemplo, tanto el cloruro de aluminio (AlCl3) como el cloruro de amonio (NH4Cl) dan lugar a soluciones acuosas ácidas.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Las soluciones de sales ácidas son ácidas al tornasol, es decir, estas soluciones vuelven rojo el papel tornasol. Por ejemplo, una solución de hidrogensulfato de sodio (NaHSO4) vuelve rojo el papel tornasol.
La solución de hidrogenocarbonato de sodio (NaHCO3), sin embargo, es ligeramente alcalina.