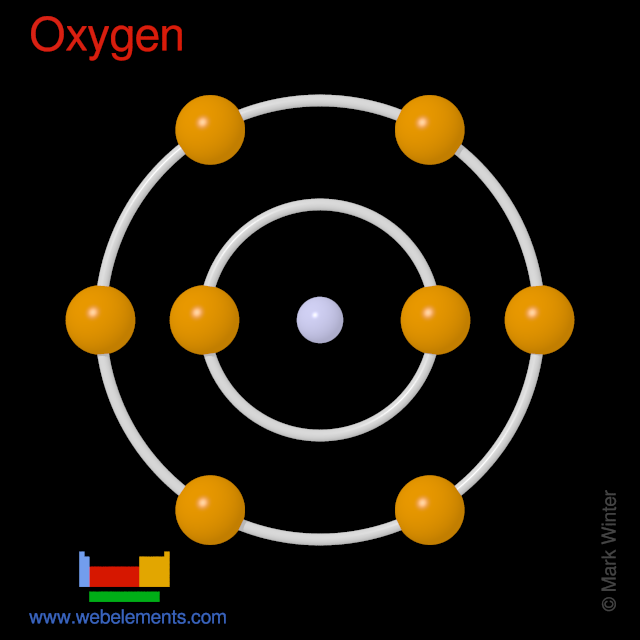
Los átomos de oxígeno tienen 8 electrones y la estructura de la corteza es 2.6.
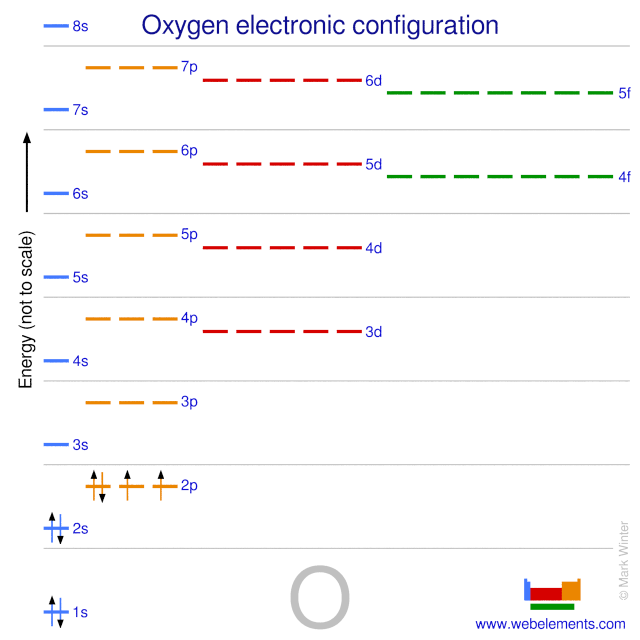
La configuración electrónica en estado básico del oxígeno neutro gaseoso es .2s2.2p4 y el símbolo del término es 3P2.
Espectro atómico
Una representación del espectro atómico del oxígeno.
Energías de ionización y afinidad electrónica
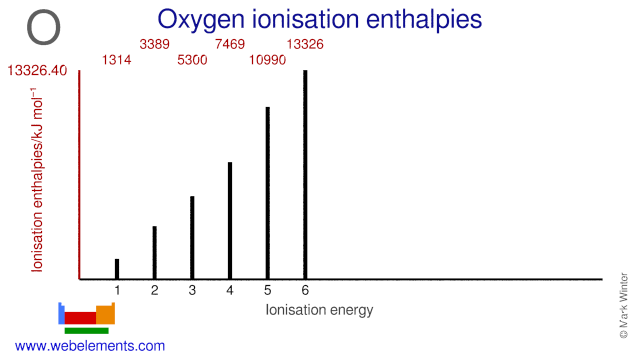
La afinidad electrónica del oxígeno es de 141 kJ mol-1. Las energías de ionización del oxígeno se dan a continuación.
| Número de energía de ionización | Entalpía / kJ mol-1 |
|---|---|
| 1er | 13.94 |
| 2° | 3388,67 |
| 3° | 5300,47 |
| 4° | 7469.27 |
| 5ª | 10989,6 |
| 6ª | 13326,4 |
| 7ª | 71334,2 |
| 8ª | 84078.3 |
Cargas nucleares efectivas
Las siguientes son cargas nucleares efectivas «Clementi-Raimondi», Zeff. Siga los hipervínculos para obtener más detalles y para los gráficos en varios formatos.
| 1s | 7.6579 | ||||||
|---|---|---|---|---|---|---|---|
| 2s | 4,49 | 2p | 4.45 | ||||
| 3s | (sin datos) | 3p | (sin datos) | 3d | (sin datos) | ||
| 4s | (sin datos) | 4p | (sin datos) | 4d | (sin datos) | 4f | (sin datos) |
| 5s | (sin datos) | 5p | (sin datos) | 5d | (sin datos) | ||
| 6s | (sin datos) | 6p | (sin datos) | ||||
| 7s | |||||||
Estas cargas nucleares efectivas, Zeff, están adaptadas de las siguientes referencias:
- E. Clementi y D.L.Raimondi, J. Chem. Phys. 1963, 38, 2686.
- E. Clementi, D.L.Raimondi y W.P. Reinhardt, J. Chem. Phys. 1967, 47, 1300.
Energías de enlace de electrones
| Etiqueta | Orbital | eV |
|---|---|---|
| K | 1s | 543.1 |
| L I | 2s | 41,6 |
Notas
Agradezco a Gwyn Williams (Jefferson Laboratory, Virginia, EE.UU.) que proporcionó los datos de energía de enlace de los electrones. Los datos están adaptados de las referencias 1-3. Están tabulados en otra parte de la WWW (referencia 4) y en papel (referencia 5).
- J. A. Bearden y A. F. Burr, «Reevaluation of X-Ray Atomic Energy Levels», Rev. Mod. Phys., 1967, 39, 125.
- M. Cardona y L. Ley, Eds., Photoemission in Solids I: General Principles (Springer-Verlag, Berlín) con correcciones adicionales, 1978.
- Gwyn Williams WWW tabla de valores
- D.R. Lide, (Ed.) en Chemical Rubber Company handbook of chemistry and physics, CRC Press, Boca Raton, Florida, USA, 81ª edición, 2000.
- J. C. Fuggle y N. Mårtensson, «Core-Level Binding Energies in Metals», J. Electron Spectrosc. Relat. Phenom, 1980, 21, 275.