Introducción
El cerebro humano experimenta una amplia maduración a lo largo de la vida para facilitar el desarrollo cognitivo. La mielinización de los axones en todo el sistema nervioso es uno de esos procesos de maduración cruciales. En el sistema nervioso central (SNC), las células gliales llamadas oligodendrocitos extienden muchos procesos en su entorno circundante, que envuelven concéntricamente la membrana alrededor de los axones para formar vainas de mielina. Las vainas de mielina permiten la rápida conducción salatoria de los potenciales de acción, localizando los canales de Na+ activados por voltaje en breves espacios entre vainas adyacentes (conocidos como nodos de Ranvier) y actuando como aislantes eléctricos. Los axones que están completamente mielinizados a lo largo de su longitud conducen los impulsos muchas veces más rápido que los axones no mielinizados del mismo tamaño de sección transversal (Waxman, 1980). Por lo tanto, los circuitos neuronales mielinizados conducen la información mucho más rápido que los circuitos no mielinizados. Los seres humanos nacen con un SNC prácticamente sin mielinizar, y la población de oligodendrocitos se expande drásticamente tras el nacimiento con una mielinización generalizada en los primeros años de la infancia. La mielinización continúa durante la adolescencia y en la edad adulta de una manera espacio-temporal característica, correlacionada con la aparición y el mantenimiento de la función adecuada del circuito. Por ejemplo, la maduración de la materia blanca (las áreas ricas en mielina del SNC) coincide con el desarrollo de los procesos cognitivos de la infancia, como la velocidad de procesamiento de la información (Mabbott et al., 2006; Scantlebury et al., 2014). Además, la patología/anomalías de la mielina se observan no solo en la enfermedad desmielinizante Esclerosis Múltiple, sino también en varias enfermedades neurodegenerativas (Kang et al., 2013; Huang et al., 2015) y trastornos del neurodesarrollo (Takahashi et al., 2011). Sin embargo, la mielinización de los axones individuales no es un fenómeno de «todo o nada». Los axones del SNC muestran una amplia variación en el número de vainas de mielina, la longitud de las vainas, el grosor de las mismas y su distribución a lo largo de su longitud. Existen muchos patrones diferentes de mielinización; por ejemplo, se han descrito axones con regiones escasamente mielinizadas en la corteza de ratones juveniles y adultos (Tomassy et al., 2014; Hill et al., 2018; Hughes et al., 2018). La modificación de cualquiera de estos parámetros de la vaina tiene efectos predecibles en la velocidad de conducción del axón subyacente – por lo tanto, establecer un patrón específico de mielinización a lo largo de un axón puede ser particularmente importante para afinar la función del circuito. Por ejemplo, los axones del tronco encefálico auditivo de los jerbos presentan vainas de mielina progresivamente más cortas a lo largo de las regiones distales para asegurar el momento preciso de la llegada de la señal y facilitar la localización del sonido (Ford et al., 2015). Los cambios sutiles en el patrón general de mielinización a lo largo de un axón (ya sea a través de la adición de nueva mielina, o la remodelación de la mielina existente) podrían cambiar profundamente la sincronización de los impulsos neuronales en los circuitos. Si la mielina es adaptable, la modificación de estos patrones de mielinización puede representar un poderoso mecanismo de regulación de la función de los circuitos a lo largo de la vida.
Las pruebas recientes sugieren que la mielina puede ser adaptable en respuesta a la actividad del circuito. Las imágenes de tensor de difusión de todo el cerebro pueden utilizarse para medir amplios cambios en la materia blanca rica en mielina a lo largo del tiempo – tales experimentos en humanos y roedores han demostrado que el aprendizaje de una nueva tarea se correlaciona con alteraciones de la materia blanca en regiones cerebrales relevantes (Scholz et al., 2009; Sampaio-Baptista et al., 2013). Los análisis a nivel celular en modelos animales demuestran que la producción de nuevos oligodendrocitos mielinizantes es necesaria para un aprendizaje motor eficiente (McKenzie et al., 2014; Xiao et al., 2016). Actualmente se plantea la hipótesis de que la actividad de los circuitos neuronales puede desencadenar cambios en la mielina; un amplio conjunto de investigaciones ha demostrado que la actividad neuronal puede influir en la proliferación de las células precursoras de oligodendrocitos (OPC), en la diferenciación de los oligodendrocitos y en la formación y el crecimiento de las vainas de mielina. Esta investigación, incluida la evidencia de las señales moleculares implicadas, se ha revisado ampliamente en otros lugares (Fields, 2015; Almeida y Lyons, 2017; Mount y Monje, 2017). La actividad neuronal podría impulsar cambios en la mielina que, a su vez, podrían cambiar las velocidades de conducción para afinar los tiempos que sustentan la función del circuito.
Sin embargo, todavía no sabemos si la mielinización de los circuitos se regula dinámicamente a lo largo de la vida, ni cómo. Los trabajos en roedores indican que se generan nuevos oligodendrocitos en todo el SNC incluso en la edad adulta (Young et al., 2013), y las OPC residen en el cerebro humano adulto (Chang et al., 2000). Los análisis de datación por carbono de tejidos humanos han identificado oligodendrocitos nacidos en la edad adulta dentro de la corteza, aunque los mismos análisis indicaron que la mayoría de los oligodendrocitos en el cuerpo calloso se originan en la primera infancia (Yeung et al., 2014). Sin embargo, los estudios de neuroimagen en humanos que correlacionan las alteraciones estructurales de la sustancia blanca con el aprendizaje de tareas sugieren que se puede formar nueva mielina durante toda la vida. Una mielinización tan prolongada requeriría, en principio, la producción de oligodendrocitos a lo largo de toda la vida, dado que los oligodendrocitos mielinizantes individuales tienen una ventana de tiempo restringida de solo unas horas para iniciar la formación de nuevas vainas (Watkins et al., 2008; Czopka et al., 2013) y el número de vainas por oligodendrocito parece estable a lo largo del tiempo (Tripathi et al., 2017). Una advertencia señalada por Mount y Monje (2017) es que la fecha de «nacimiento» en el experimento de datación por carbono (que identifica el momento de la replicación del ADN durante la división celular), refleja la del OPC, no necesariamente la del oligodendrocito diferenciado. Esto es importante dada la evidencia de que las OPCs pueden diferenciarse directamente en oligodendrocitos sin división celular, al menos en roedores (Hughes et al., 2013). Las OPC del cuerpo calloso podrían diferenciarse directamente en oligodendrocitos muchos años después de su división celular terminal; por tanto, el momento de la diferenciación de estos nuevos oligodendrocitos no puede determinarse mediante la datación por carbono, por lo que Yeung et al. (2014) pueden haber subestimado la tasa de producción de oligodendrocitos en el cerebro humano adulto. Todavía nos queda mucho por aprender sobre las contribuciones relativas de la generación de oligodendrocitos y la remodelación de la mielina al desarrollo del SNC a lo largo de la vida.
Para comprender plenamente la dinámica precisa de la oligodendrogénesis, la formación de mielina y la remodelación de la mielina a lo largo de las distintas etapas de la vida, las imágenes longitudinales de alta resolución representan el enfoque de referencia. Aquí proporcionamos una visión general de los recientes estudios de imagen in vivo que están comenzando a aclarar la dinámica de la mielinización, lo que también nos permitirá comenzar a entender cómo dicha dinámica podría impactar en la función del circuito neuronal.
Mielinización de novo
Para comenzar a abordar definitivamente cómo se generan los oligodendrocitos y cómo se fabrica la mielina y se remodela dinámicamente in vivo, dos estudios recientes utilizaron imágenes repetidas de dos fotones de la corteza somatosensorial del ratón durante largos períodos de tiempo. Hughes et al. (2018) obtuvieron imágenes de la corteza de ratones transgénicos reporteros con células de linaje oligodendroglial marcadas con fluorescencia desde la edad adulta temprana, hasta la edad media y avanzada (aproximadamente P720). Descubrieron que la población de oligodendrocitos continúa expandiéndose y que la densidad de oligodendrocitos corticales casi se duplica entre las etapas de adulto joven y de mediana edad (Figura 1A). Esto va acompañado de un aumento de más del doble en el número de vainas de mielina corticales. Pero, ¿cómo aumenta el número de oligodendrocitos? En el desarrollo postnatal temprano se producen muchos oligodendrocitos, pero sólo un subconjunto sobrevive y llega a mielinizar los axones (Barres et al., 1992). Esto parece ser similar en la edad adulta – mediante el seguimiento de OPCs corticales individuales en la corteza adulta durante hasta 50 días, Hughes et al. (2018) revelaron que la mayoría de los oligodendrocitos recién diferenciados sufren la muerte celular, y sólo el 22% sobrevive y se compromete a la mielinización (Figura 1B). Sigue sin saberse qué proporción de oligodendrocitos recién diferenciados se genera tras la división de OPC frente a la diferenciación directa. Sin embargo, una vez que los oligodendrocitos se comprometen a la mielinización, permanecen estables, sin evidencia de que los oligodendrocitos mielinizantes sufran la muerte celular durante un período de imágenes de 50 días.
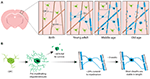
FIGURA 1. Dinámica de los oligodendrocitos y la mielina en la corteza de los mamíferos a lo largo de la vida. (A) Las células precursoras de oligodendrocitos (OPC) generan continuamente nuevos oligodendrocitos mielinizantes (OL) en la corteza somatosensorial desde el nacimiento hasta la mediana edad. La población de OLs disminuye entonces en la vejez, acompañada de una reducción de la cobertura de mielina. (B) El rastreo de linaje de OPCs individuales muestra que aunque los OL premielinizantes se producen continuamente en la edad adulta, sólo aproximadamente el 20% sobrevive para mielinizarse. La mayoría de las vainas de mielina, una vez formadas, son estables en longitud durante un período prolongado de tiempo, lo que indica que normalmente hay muy poca remodelación de la mielina existente. Resumen de los datos de Hill et al. (2018) y Hughes et al. (2018).
De manera similar, Hill et al. (2018) utilizaron reporteros transgénicos de oligodendrocitos y la técnica de microscopía de reflectancia confocal espectral sin etiquetas (SCoRe) para obtener imágenes de la mielina a lo largo de los axones (Schain et al., 2014) en la corteza somatosensorial de ratones juveniles, adultos jóvenes, de mediana edad y de edad avanzada (P950). También descubrieron que el número de oligodendrocitos continúa expandiéndose en la edad adulta hasta P650, y que los oligodendrocitos son estables en la edad media hasta 80 días de imagen. Descubrieron que la mielinización de la corteza también alcanza su punto máximo en la edad media a P650, y que la densidad de oligodendrocitos desciende significativamente desde su punto máximo (a P650) hasta la edad avanzada (P950) (Figura 1A). Esto se reflejó en una reducción de la cobertura de mielina de los axones corticales de la capa I entre P650 y P950. La supervivencia de los oligodendrocitos a largo plazo puede variar entre las diferentes partes del SNC. Tripathi et al. (2017) etiquetaron oligodendrocitos mielinizantes en P60 en ratones y luego contaron cuántas células etiquetadas sobrevivieron hasta P605 en varias regiones del SNC. Encontraron que en la médula espinal y la corteza motora, el 60-70% de las células etiquetadas en P60 sobrevivieron, mientras que en el cuerpo calloso, más del 90% de las células etiquetadas en P60 sobrevivieron. La reducción del número de oligodendrocitos y de la mielinización en determinadas regiones del SNC con la edad plantea cuestiones intrigantes sobre el papel de la pérdida de mielina en el deterioro cognitivo asociado a la edad. Los análisis de IRM muestran que la microestructura de la materia blanca se correlaciona con la inteligencia fluida (Ritchie et al., 2015), pero también que esta microestructura de la materia blanca se deteriora con el aumento de la edad (Cox et al., 2016). La posterior pérdida de mielina asociada a la edad podría conducir a una reducción de la función cognitiva debido a la desregulación de los circuitos mielinizados.
¿Podría la generación de nuevos oligodendrocitos (y posteriormente de nueva mielina) en la corteza adulta responder a la actividad del circuito? Investigaciones anteriores han demostrado que la reducción de la entrada sensorial mediante la eliminación de los bigotes de los ratones conduce a una reducción de la oligodendrogénesis en la corteza somatosensorial (Hill et al., 2014). Para investigar esto más a fondo, Hughes et al. (2018) proporcionaron a ratones adultos (P365) estimulación sensorial durante 3 semanas colgando cuentas en las jaulas de los animales para estimular repetidamente sus bigotes y, por tanto, la corteza somatosensorial. Al obtener imágenes de la corteza somatosensorial antes y después de las 3 semanas, demostraron que la estimulación sensorial aumenta el número de oligodendrocitos, potencialmente debido a la mayor supervivencia de las células recién diferenciadas. Kougioumtzidou et al. (2017) proporcionaron más pruebas de que la actividad del circuito puede ser importante en la regulación de la supervivencia celular: demostraron que la pérdida de las subunidades 2, 3 y 4 del receptor AMPA en los OPCs conduce a una menor supervivencia de los oligodendrocitos. Esto sugiere que la mielinización de novo podría ser modulada por la actividad de los circuitos corticales a lo largo de la vida, tal vez para afinar la función de esos mismos circuitos.
Quedan por abordar muchas cuestiones: ¿cuál es el efecto de la oligodendrogénesis y la nueva mielinización en la función real del circuito? ¿Aumenta la actividad neuronal la supervivencia a largo plazo de los oligodendrocitos mielinizantes? Es posible que la pérdida de oligodendrocitos en la vejez se deba a la reducción de la actividad neuronal asociada a la edad, lo que podría, a su vez, afectar a la supervivencia general de los oligodendrocitos. Otra posibilidad es que los oligodendrocitos tengan una vida útil limitada independientemente de la actividad neuronal (ya sea programada intrínsecamente o influida por otras señales extrínsecas asociadas al envejecimiento). En cualquiera de los casos, la estimulación del circuito podría ayudar a aliviar la pérdida de mielina asociada a la edad, ya sea promoviendo la supervivencia de los oligodendrocitos existentes o estimulando la producción de nuevos oligodendrocitos. Esto, a su vez, podría tener implicaciones significativas en el tratamiento y la prevención del deterioro cognitivo asociado a la edad.
La oligodendrogénesis mediada por la actividad no se limita a la corteza somatosensorial: los ratones adultos jóvenes sometidos a aprendizaje motor también muestran un aumento en el número de oligodendrocitos recién diferenciados en la corteza motora (Xiao et al., 2016). ¿Qué pasa con otras áreas del SNC? Muchos axones corticales se proyectan a través del cuerpo calloso y, por lo tanto, la estimulación de los circuitos corticales podría señalar tanto a los OPC corticales como a los callosos. Dos estudios en roedores han demostrado que la estimulación de las neuronas corticales induce la oligodendrogénesis dentro del cuerpo calloso. Gibson et al. (2014) estimularon optogenéticamente las neuronas de proyección de la capa V en la corteza premotora, encontrando un aumento en la proliferación de OPC tanto en la corteza premotora como en el cuerpo calloso. Esto condujo a un aumento del número de oligodendrocitos y del grosor de la vaina 4 semanas después de la estimulación. Más recientemente, Mitew et al. (2018) utilizaron Receptores de Diseño Activados Exclusivamente por Fármacos de Diseño para estimular las neuronas somatosensoriales de la capa 2/3, y también observaron un aumento de la proliferación de OPC, de la oligodendrogénesis y del grosor de las vainas de mielina en el cuerpo calloso tanto en ratones jóvenes como adultos. También demostraron que los nuevos oligodendrocitos forman preferentemente vainas de mielina en los axones activos. Esto indica que la mielinización de novo inducida por la actividad puede, en principio, dirigirse a los axones/circuitos activos. Aún se desconoce la duración de los cambios en la mielina en respuesta a la actividad neuronal. La supervivencia a largo plazo de las células mielinizantes observada por Tripathi et al. (2017), Hill et al. (2018) y Hughes et al. (2018) sugiere que una vez que un oligodendrocito forma vainas de mielina es probable que sobreviva incluso si los niveles de actividad neuronal vuelven a bajar a la línea de base. Si las propias vainas de mielina cambian una vez que la actividad neuronal vuelve a los niveles normales requiere una mayor investigación de la dinámica de las vainas individuales, que se discute a continuación.
Por lo tanto, es posible que la mielinización de novo de por vida pueda ocurrir en muchas regiones del SNC, donde los axones adecuados para la mielinización tienen suficiente espacio sin mielinizar. Sin embargo, sigue sin estar claro hasta qué punto la oligodendrogénesis continúa en diferentes áreas del cerebro humano adulto. Los análisis de datación por carbono sugieren que la mayoría de los oligodendrocitos del tracto del cuerpo calloso se generan en la primera infancia (Yeung et al., 2014). El análisis inmunohistoquímico del tejido cerebral humano utilizando un nuevo marcador de oligodendrocitos recién diferenciados (BCAS1) muestra nuevos oligodendrocitos en la corteza frontal incluso más allá de la mediana edad, pero muy pocos oligodendrocitos nuevos en la materia blanca después de la tercera década de vida (Fard et al., 2017). Esta diferencia en la oligodendrogénesis entre especies podría ser resultado de la escala. Los datos de Hughes et al. (2013) sobre roedores sugieren que los oligodendrocitos se generan en enorme exceso, con una poda continua de casi el 80% de las células. Dado el coste energético de tal proceso, ¿es este mecanismo sostenible durante toda la vida en un órgano del tamaño del cerebro humano? Tal vez en el cerebro humano haya una sobreproducción limitada de oligodendrocitos, debido a la necesidad de una mielinización más prolongada del SNC de mayor tamaño, o porque señales como la actividad neuronal estimulan a los OPC para que se diferencien en oligodendrocitos como y cuando sea necesario.
Remodelación de la mielina
La remodelación de las vainas de mielina existentes podría alterar las propiedades de conducción sin necesidad de generar nuevos oligodendrocitos o mielina. La modificación de las longitudes de las vainas de mielina existentes podría cambiar la cobertura de mielina a lo largo de un axón y la distancia entre los nodos de Ranvier (lo que repercutiría en la velocidad de conducción). Además, incluso una remodelación muy sutil de la mielina podría alterar las longitudes de los propios nodos. Recientemente se ha demostrado que la longitud de los nodos puede variar ampliamente en el nervio óptico y en la corteza, y que cambiar las longitudes de los nodos a lo largo de un axón puede, en principio, también alterar significativamente la velocidad de conducción (Arancibia-Cárcamo et al., 2017). Queda por determinar si los cambios en el nodo de Ranvier son impulsados principalmente por la mielinización o por la reorganización del propio axón.
Tanto Hill et al. (2018) como Hughes et al. (2018) realizaron un estudio longitudinal de vainas de mielina individuales en la corteza somatosensorial de ratón durante varias semanas para evaluar si las longitudes de las vainas se regulan dinámicamente. Hill et al. (2018) encontraron que, en la edad adulta temprana (P90-120), aunque algunas vainas exhiben extensión o contracción, el 81% de las vainas observadas eran estables. Es posible que se estabilice la longitud de más vainas con la edad; Hughes et al. (2018) hicieron un seguimiento de las vainas en animales de mayor edad (P365) y vieron que el 99% de las vainas se mantenían estables a lo largo de 3 semanas (Figura 1B).
También se ha descrito una estabilidad similar de la longitud de las vainas en otros lugares; Auer et al. (2018) utilizaron peces cebra larvales para investigar si las vainas individuales pueden cambiar de longitud a lo largo del tiempo mediante la obtención de imágenes en vivo de curso temporal de vainas de mielina marcadas con fluorescencia. Descubrieron que las vainas individuales experimentan un crecimiento rápido pero variable en los primeros días tras su formación, antes de estabilizar su longitud. Una vez estabilizadas, las vainas sólo siguen creciendo para adaptarse al crecimiento general del animal.
¿Por qué algunas vainas de la corteza cambian de longitud, mientras que otras no lo hacen? Esto puede reflejar la diversidad en las demandas de los distintos circuitos neuronales. Se ha observado diversidad axonal durante la mielinización inicial en la médula espinal del pez cebra, donde algunos axones utilizan la liberación de vesículas sinápticas para regular el número y la longitud de las vainas de mielina, mientras que otros no lo hacen (Koudelka et al., 2016). Esto plantea la intrigante hipótesis de que solo algunos axones son capaces de regular la mielina mediante señales relacionadas con la actividad. Hughes et al. (2018) descubrieron que su paradigma de estimulación sensorial no aumentaba la proporción de vainas dinámicas en la corteza somatosensorial. Sin embargo, un análisis más detallado de la diversidad de subtipos de axones junto con un estudio longitudinal de la dinámica de la longitud de las vainas podría confirmar si la remodelación de la longitud de las vainas es específica de ciertos circuitos.
¿La estabilidad de la longitud de las vainas refleja una incapacidad de las vainas para remodelarse? Los experimentos en el pez cebra sugieren que la remodelación de la longitud de la vaina puede ser inducida cuando se interrumpe el perfil de mielinización de un axón. Auer et al. (2018) ablacionaron oligodendrocitos individuales y, por lo tanto, eliminaron escasamente las vainas a lo largo de los axones. Descubrieron que cuando se pierde una sola vaina de mielina en un axón totalmente mielinizado, las vainas vecinas podrían reiniciar un rápido crecimiento para cubrir el hueco no mielinizado. En varios casos, se formaba una nueva vaina de mielina en lugar de su predecesora y podía incluso empujar hacia atrás contra las vainas vecinas invasoras para restaurar el patrón original de mielinización (Figura 2A). Por lo tanto, a veces se mantiene preferentemente un patrón de mielinización específico, incluso después de la interrupción de la mielina. Esto puede ser para mantener las propiedades de conducción optimizadas del axón subyacente. Auer et al. (2018) observaron axones escasamente mielinizados en el pez cebra larvario, como se había identificado previamente en la corteza de los roedores. Curiosamente, descubrieron que tras la ablación de vainas individuales en dichos axones escasamente mielinizados se formaba una nueva vaina prácticamente en el mismo lugar que la vaina ablacionada, incluso a lo largo de un tramo del axón que de otro modo no estaría mielinizado (Figura 2B). Por lo tanto, los patrones de mielinización a lo largo de los axones escasamente mielinizados también parecen mantenerse de forma estable en el pez cebra, como sugieren Hill et al. (2018) en roedores. La función de los perfiles de mielinización escasa sigue siendo desconocida. Tales patrones pueden permitir un ajuste fino más dinámico de la función de un solo axón a lo largo del tiempo, aunque también es posible que tales brechas no mielinizadas puedan facilitar la mielinización gradual para mantener tiempos de conducción consistentes dentro de los circuitos, a medida que el animal crece y/o las longitudes de los axones cambian.
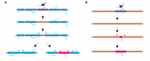
FIGURA 2. La remodelación de la mielina puede ocurrir in vivo. (A) La ablación de vainas individuales en un axón completamente mielinizado puede inducir el rápido crecimiento de vainas vecinas para cubrir el hueco. Esta brecha puede ser cubierta por completo por las vainas vecinas, o el perfil de mielinización original puede ser restaurado por la adición de una nueva vaina. (B) La ablación de una vaina en un axón escasamente mielinizado va seguida de la formación de una nueva vaina de mielina de tamaño y ubicación idénticos a la vaina predecesora ablacionada. Resumen de los datos de Auer et al. (2018).
¿Las vainas de mielina estables en los mamíferos también tienen esta capacidad de remodelación cuando se interrumpe el patrón de mielinización? Se necesitan más estudios longitudinales unidos a la desmielinización para responder a esta pregunta. Es posible que dicha remodelación no sea inducida por la actividad neuronal, sino que sea un mecanismo compensatorio de la pérdida de mielina. La pérdida de oligodendrocitos asociada a la edad podría desencadenar la remodelación de las vainas supervivientes para cubrir las porciones denudadas del axón y, por tanto, ayudar a mantener la función del circuito. Las imágenes en vivo de las vainas de mielina en la vejez podrían determinar si este es el caso.
Todos los estudios de imágenes en vivo discutidos aquí han evaluado la dinámica de la longitud de la vaina de mielina, pero no el grosor de la vaina de mielina. ¿Puede regularse dinámicamente el grosor de la vaina? La estimulación de la señalización PI3K/AKT/mTOR en los oligodendrocitos de ratones adultos desencadena una envoltura adicional de la mielina para aumentar el grosor de la vaina (Snaidero et al., 2014). Esto puede estar modulado por la actividad del circuito, ya que la estimulación neuronal provoca un aumento del grosor de la vaina tanto en ratones jóvenes como adultos (Gibson et al., 2014; Mitew et al., 2018). Esto pone de manifiesto la necesidad de obtener imágenes de todos los parámetros de la vaina de forma longitudinal para comprender plenamente la dinámica de la remodelación de la vaina. Se necesitan modalidades de imagen en vivo para medir con precisión el grosor de la vaina a lo largo de los axones, ya que actualmente esto requiere una medición transversal mediante microscopía electrónica, lo que limita el análisis a un único punto temporal. Algunas técnicas de imagen sin etiquetas, como la microscopía de generación de tercer armónico y la reflectometría espectral, son prometedoras para realizar dichas mediciones (Lim et al., 2014; Kwon et al., 2017). El acoplamiento de estas técnicas con estudios longitudinales de la corteza de roedores podría determinar si las vainas de mielina establecidas pueden ajustar su grosor, o si la actividad neuronal simplemente empuja la mielinización de novo para producir vainas más gruesas.
Por lo tanto, parece que, aunque las vainas de mielina son capaces de remodelarse cuando la mielina se interrumpe, la mayoría de las vainas son generalmente estables en longitud. Esta estabilidad puede deberse al mantenimiento de patrones de mielinización tempranamente establecidos y optimizados para la función del circuito.
El futuro
Los estudios recientes de imagen en mamíferos se han centrado en la mielinización de novo y la remodelación de las vainas en la materia gris cortical. Los circuitos corticales reciben y envían información a través de muchas regiones, como la médula espinal y el cuerpo calloso, por lo que los cambios en la mielina en varias áreas diferentes del SNC podrían alterar la señalización en un solo circuito. El SNC se describe tradicionalmente por su aspecto tras la fijación con formaldehído, donde la «materia blanca» describe los tractos axonales fuertemente mielinizados, mientras que la «materia gris» describe las regiones densamente pobladas de cuerpos celulares neuronales, dendritas y sinapsis. Sin embargo, esta clasificación es demasiado simplista; los OPCs producen oligodendrocitos mielinizantes tanto en la materia gris como en la blanca (Dawson et al., 2003), y de hecho hay pruebas emergentes de diversidad en el linaje oligodendroglial y en los patrones de mielinización tanto en la materia gris como en la blanca (Rivers et al., 2008; Viganò et al., 2013; Young et al., 2013; Bechler et al., 2015). Esta diversidad puede reflejar los requisitos únicos de la mielina en distintas áreas, y potencialmente en distintos circuitos, del SNC. Se requieren más estudios de imágenes longitudinales para comprender mejor la dinámica de la mielinización de novo y la remodelación de la vaina en áreas del SNC más allá de la corteza.
Mientras que la transparencia óptica del pez cebra larvario se presta a la obtención de imágenes en vivo no invasivas, la realización de tales experimentos en el SNC de los mamíferos es más invasiva y técnicamente desafiante. Hill et al. (2018) y Hughes et al. (2018) utilizaron microscopía de dos fotones con ventanas de imagen craneal para obtener imágenes de profundidades de hasta 400 μm en la corteza. Podrían utilizarse técnicas similares para obtener imágenes de tractos mielinizados superficiales en la médula espinal a lo largo del tiempo (Locatelli et al., 2018), pero las regiones más profundas del SNC no pueden ser penetradas solo por la microscopía de dos fotones. Una alternativa es utilizar la microendoscopia de dos fotones, donde una sonda de microendoscopio con una lente de índice de refracción de gradiente (GRIN) se inserta en el tejido para obtener imágenes de las células más profundas del cerebro . Sin embargo, la inserción del endoscopio puede provocar respuestas inflamatorias que podrían afectar a la mielinización. Una alternativa podría ser la microscopía de tres fotones utilizando el método de ventana de imagen craneal, que también se ha utilizado previamente para obtener imágenes del hipocampo (Horton et al., 2013; Ouzounov et al., 2017). La microscopía de tres fotones proporciona una relación señal/fondo significativamente mayor que la microscopía de dos fotones y, por lo tanto, puede utilizarse para obtener imágenes de estructuras tisulares más profundas.
Es especialmente importante tener en cuenta no solo diferentes regiones del SNC, sino diferentes neuronas dentro de estas regiones. Investigaciones anteriores sugieren que existen diferencias mecánicas en la forma en que los distintos subtipos de neuronas regulan su mielinización (Koudelka et al., 2016). Además, puede haber diversidad en la regulación local de la mielina. Es esencial recordar que las diferentes partes del SNC no son entidades separadas, sino que están interconectadas. La integración de la conectómica a mesoescala, que se centra en la comprensión de las conexiones de los diferentes subtipos de neuronas a través de diferentes regiones (Zeng, 2018), será crucial para nuestra comprensión de cómo la dinámica de mielinización de toda la vida varía entre los diferentes circuitos.
¿Cuál es la consecuencia funcional de la regulación de la mielina a lo largo de distintos circuitos? Hasta ahora, las implicaciones funcionales sólo pueden inferirse mediante correlaciones con el comportamiento. En última instancia, es necesario acoplar la medición de la dinámica de la mielina con la evaluación directa de la actividad del circuito. Esto requerirá el registro de la actividad neuronal durante los estudios longitudinales de la mielinización para conectar directamente la mielinización de novo o la remodelación de la vaina observada con los cambios en la función del circuito con el tiempo. Será importante medir la dinámica de la mielina y la actividad electrofisiológica de neuronas y axones individuales para determinar cómo los cambios en los diversos parámetros de la vaina de mielina afectan realmente a las propiedades de conducción a nivel de célula individual, así como evaluar la actividad a nivel de población. Herramientas como los indicadores de Ca2+ o de voltaje codificados genéticamente permiten un registro relativamente no invasivo de la actividad del circuito, e incluso pueden utilizarse para evaluar la actividad del circuito de todo el cerebro (Ahrens et al., 2012; Lovett-Barron et al., 2017).
Conclusión
La mielinización de los axones representa un poderoso mecanismo potencial para regular la función del circuito durante toda la vida. La investigación ha demostrado que la mielinización de novo en la corteza (a través de la producción de nuevos oligodendrocitos) se produce incluso en la edad adulta, y que esto puede ser potenciado mediante la estimulación de la actividad del circuito. Una vez que se ha formado la mielina, ésta es estable, con poco recambio de oligodendrocitos y una remodelación limitada de las longitudes de las vainas de mielina existentes. Sin embargo, estas estructuras estables pueden conservar la capacidad de remodelación si se altera la mielina. Esto tiene interesantes implicaciones en cuanto a la plasticidad de la mielina en el mantenimiento de la función del circuito durante las lesiones, la enfermedad y la vejez. Todavía está por ver cómo afectan los cambios en la mielina a la función del circuito subyacente. En última instancia, se requiere un enfoque a nivel de circuito, que integre el análisis de la dinámica de la mielina con la medición directa de la función del circuito, para apreciar plenamente cómo la mielinización dinámica influye en la función general del sistema nervioso a lo largo de la vida.
Contribuciones de los autores
Todos los autores enumerados han hecho una contribución sustancial, directa e intelectual al trabajo, y lo han aprobado para su publicación.
Financiación
DAL cuenta con el apoyo de una beca de investigación senior del Wellcome Trust (102836/Z/13/Z). JMW cuenta con el apoyo de una beca de doctorado en reparación de tejidos de la Universidad de Edimburgo (MRC Doctoral Training Partnership MR/K501293/1) y del programa de doctorado de cuatro años en reparación de tejidos del Wellcome Trust (Grant 108906/Z/15/Z).
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Brain-wide neuronal dynamics during motor adaptation in zebrafish. Nature 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., and Lyons, D. A. (2017). Sobre la plasticidad de los axones mielinizados y la formación y función de los circuitos neuronales. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K., y Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed (Longitud del nodo de Ranvier como posible regulador de la velocidad de conducción de los axones mielinizados). eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). Evidencia de la remodelación de la vaina de mielina en el SNC revelada por imágenes in vivo. Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Cell death and control of cell survival in the oligodendrocyte lineage. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015). Las longitudes de las vainas de mielina del SNC son una propiedad intrínseca de los oligodendrocitos. Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., y Trapp, B. D. (2000). NG2-positive oligodendrocyte progenitor cells in adult human brain and multiple sclerosis lesions. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Ageing and brain white matter structure in 3,513 UK Biobank participants (Envejecimiento y estructura de la materia blanca del cerebro en 3,513 participantes del Biobanco del Reino Unido). Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., and Lyons, D. A. (2013). Los oligodendrocitos individuales tienen sólo unas horas para generar nuevas vainas de mielina in vivo. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., and Reynolds, R. (2003). NG2-expressing glial progenitor cells: an abundant and widespread population of cycling cells in the adult rat CNS. Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). La expresión de BCAS1 define una población de oligodendrocitos mielinizantes tempranos en lesiones de esclerosis múltiple. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Un nuevo mecanismo de plasticidad del sistema nervioso: la mielinización dependiente de la actividad. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Ajuste de las propiedades del nodo de Ranvier y del entrenudo en los axones mielinizados para ajustar el tiempo del potencial de acción. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). La actividad neuronal promueve la oligodendrogénesis y la mielinización adaptativa en el cerebro de los mamíferos. Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., and Grutzendler, J. (2018). Plasticidad de la mielina cortical de por vida y degeneración relacionada con la edad en el cerebro de mamíferos vivos. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., y Nishiyama, A. (2014). Modulación de la generación de oligodendrocitos durante una ventana temporal crítica después de la división de las células NG2. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. (2013). Microscopía de tres fotones in vivo de estructuras subcorticales dentro de un cerebro de ratón intacto. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). La huntingtina mutante regula a la baja la expresión genética de la mielina mediada por el factor regulador de la mielina y afecta a los oligodendrocitos maduros. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M., y Bergles, D. E. (2013). Los progenitores de oligodendrocitos equilibran el crecimiento con la autorrepresión para lograr la homeostasis en el cerebro adulto. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., and Bergles, D. E. (2018). Remodelación de la mielina a través de la oligodendrogénesis dependiente de la experiencia en la corteza somatosensorial adulta. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., y Schnitzer, M. J. (2004). In vivo mammalian brain imaging using one- and two-photon fluorescence microendoscopy. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). Degeneración y deterioro de la regeneración de los oligodendrocitos de la materia gris en la esclerosis lateral amiotrófica. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Los subtipos neuronales individuales muestran diversidad en la mielinización del SNC mediada por la liberación de vesículas sinápticas. Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). La señalización a través de los receptores AMPA en los precursores de oligodendrocitos promueve la mielinización mediante la mejora de la supervivencia de los oligodendrocitos. eLife 6:e28080. doi: 10.7554/eLife.28080
Abstracto de PubMed | Texto completo de la encuesta de Google
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Metrología óptica a nanoescala sin etiquetas en axones mielinizados in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., y Webb, W. W. (2004). Microscopía multifotónica in vivo del tejido cerebral profundo. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., y Melendez-Vasquez, C. V. (2014). Label-free imaging of Schwann cell myelination by third harmonic generation microscopy. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Los fagocitos mononucleares especifican y adaptan localmente su fenotipo en un modelo de esclerosis múltiple. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Circuitos ancestrales para la modulación coordinada del estado cerebral. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., y Rockel, C. (2006). White matter growth as a mechanism of cognitive development in children. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). Motor skill learning requires active central myelination. Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). La estimulación farmacogenética de la actividad neuronal aumenta la mielinización de manera específica para el axón. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., y Monje, M. (2017). Envuelto para adaptarse: mielinización dependiente de la experiencia. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). Imágenes de tres fotones in vivo de la actividad de las neuronas marcadas con GCaMP6 en lo profundo del cerebro de un ratón intacto. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Cambios acoplados en la microestructura de la materia blanca del cerebro y la inteligencia fluida en la vida posterior. J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). La glía PDGFRA/NG2 genera oligodendrocitos mielinizantes y neuronas de proyección piriforme en ratones adultos. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). Motor skill learning induces changes in white matter microstructure and myelination. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). Relaciones entre la maduración de la materia blanca y el tiempo de reacción en la infancia. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., and Grutzendler, J. (2014). Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., and Johansen-berg, H. (2009). El entrenamiento induce cambios en la arquitectura de la materia blanca. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). Envoltura de la membrana de mielina de los axones del SNC por el crecimiento polarizado dependiente de PI(3,4,5)P3 en la lengua interna. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., and Buxbaum, J. D. (2011). Vinculación de la disfunción de los oligodendrocitos y la mielina a las anormalidades del neurocircuito en la esquizofrenia. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. (2014). Distintos perfiles de distribución de mielina a lo largo de los axones individuales de las neuronas piramidales en el neocórtex. Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., and Richardson, W. D. (2017). Notable estabilidad de los oligodendrocitos mielinizantes en ratones. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., y Dimou, L. (2013). El trasplante revela diferencias regionales en la diferenciación de oligodendrocitos en el cerebro adulto. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., and Barres, B. A. (2008). Distintas etapas de mielinización reguladas por la gamma-secretasa y los astrocitos en un sistema de cocultivo del SNC de rápida mielinización. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Determinantes de la velocidad de conducción en las fibras nerviosas mielinizadas. Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). La producción rápida de nuevos oligodendrocitos es necesaria en las primeras etapas del aprendizaje de habilidades motoras. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Dinámica de la generación de oligodendrocitos y la mielinización en el cerebro humano. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Oligodendrocyte dynamics in the healthy adult CNS: evidence for myelin remodeling. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Conectómica a mesoescala. Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar