Aspartato aminotransferasa por Luke Spooner
Contenidos
- 1 Función
- 2 Estructura
- 3 Función
- 4 Aplicaciones clínicas
- 5 Estructuras 3D de la aspartato aminotransferasa
.
Función
Aspartato aminotransferasa (AAT), también conocida como transaminasa glutámica aspártica, transaminasa glutámica oxalacética, prefenato aminotransferasa y transaminasa A es una enzima que es miembro de la familia de las aminotransferasas dependientes de piridoxal-fosfato de clase I . Está codificada por el gen GOT1. Es un homodímero de 413 aminoácidos y desempeña un papel fundamental en el metabolismo de los aminoácidos y los hidratos de carbono, la ureogénesis y la transferencia de equivalentes reductores a la mitocondria y el cloroplasto. En las células procariotas se encuentra exclusivamente en el citosol, pero en las células eucariotas existen isozimas de citosol, mitocondriales y de cloroplasto. La aspartato aminotransferasa bifuncional (BAAT) es necesaria para la transaminación del prefanato en arogenato.
En el cuerpo humano se produce en el cerebro, los músculos esqueléticos, el hígado, el páncreas, los glóbulos rojos y los riñones . La amplia gama de tejidos en los que se produce, la separa de la enzima similar alanina transaminasa (ALT) que se encuentra principalmente en el hígado. El nivel de AAT en el organismo puede utilizarse como marcador de enfermedades o daños en los tejidos. Además, los niveles de AAT y ALT pueden compararse para determinar si el daño tisular se encuentra principalmente en el hígado.
Estructura
que contiene (hélices alfa, hebras beta , bucles , giros). Unidad asimétrica de Aspartato aminotransferasa, con dominio pequeño y grande destacados y cofactor PLP (1b4x). Cada subunidad contiene un sitio activo equivalente. Las subunidades se conectan en dos sitios: entre sus dominios grandes y entre los residuos N-terminales y el dominio grande en la otra subunidad. Esta estructura de la AST varía minuciosamente entre los organismos, desde E. coli hasta los seres humanos. Además, la estructura del sitio activo está muy conservada con una homología de secuencia del 25%.
Cada subunidad del homodímero se divide además en un dominio pequeño y uno grande. El está compuesto por los aminoácidos desde el N-terminal hasta el residuo Pro 48 y desde Met 326 hasta el C-terminal. Los aminoácidos restantes conforman el , y el están conectados por una larga α-hélice que consta de 32 aminoácidos.
El dominio grande es donde se encuentra el sitio activo de la AAT y para acomodarlo, el núcleo contiene muchas estructuras α/β supersecundarias. Esto contrasta con el núcleo de la subunidad pequeña, que está formado por dos hélices α y dos filamentos β. En los organismos multicelulares hay un pliegue en el residuo 325 que actúa como bisagra para el dominio pequeño, lo que permite los cambios conformacionales resultantes que tienen lugar al unirse los inhibidores a la enzima.
Como se ha dicho anteriormente, el sitio activo de la AST está situado en el dominio grande de la subunidad. Dentro del sitio activo se encuentra el residuo amino Lys 258, también conocido como la aldimina interna, que se une con el cofactor Piridoxal 5′-fosfato () formando lo que se denomina una base de Schiff. Al añadir un sustrato de aminoácido, se forma una nueva base de Schiiff entre el PLP y el aminoácido.
Función
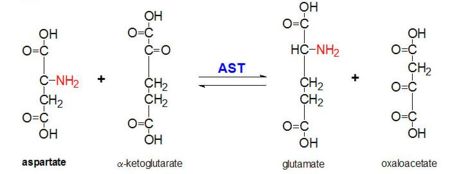
Figura 2: Reacción de transaminación de L-aspartato y α-cetoglutarato catalizada por la aspartato aminotransferasa
La AAT cataliza la transaminación reversible del grupo α-amino de L-aspartato a α-cetoglutarato formando oxaloacetato y glutamato. Esta reactividad es menor en E.coli que en eucariotas superiores, y tiene una especificidad de sustrato más amplia. Sin embargo, la reacción tiene lugar de la misma manera. Al introducir un aminoácido como sustrato, se forma una nueva base de Schiff entre éste y el cofactor PLP. Esto hace que el aminoácido pierda un hidrógeno y forme un intermedio quinoide, y la reprotanación tiene lugar dando lugar a una quimina. A continuación, la estructura se hidroliza formando un α-cetoácido y fosfato de piridoxamina. El 2-metil aspartato actúa como inhibidor de la AAT cuando forma una base Schiif con el cofactor PLP, en lugar del aspartato. Esto hace que el proceso se detenga en el paso anterior a la eliminación de la proteína alfa.
Esta reacción es esencial para mantener la homeostasis en los organismos. Las cuatro moléculas diferentes que pueden formarse como resultado de esta transanimación (oxaloacetato, α-cetoglutarato, aspartato, L-glutamato) nuestra crítica para un número de procesos metabólicos. El oxaloacetato y el α-cetoglutarato desempeñan un papel fundamental en el ciclo de Krebs, diversas formas de aspartato son moléculas importantes en el ciclo de la urea y participan en la gluconeogénesis, y el glutamato es una molécula importante en las vías metabólicas asociadas a la memoria.
Aplicaciones clínicas
Los niveles de AAT en el organismo son indicativos de daño tisular y enfermedad. Normalmente, la AAT se encuentra en cantidades mínimas dentro de la sangre, sin embargo, cuando los órganos mencionados anteriormente están dañados, la AAT se libera en la sangre. La cantidad liberada es proporcional al nivel de daño sufrido. Se ha demostrado que los niveles de AAT aumentan sustancialmente en las 6 horas siguientes a la degradación inicial del tejido y pueden permanecer elevados hasta 4 días. Los niveles de AAT, cuando se comparan con los niveles de otras enzimas, pueden ser utilizados por los médicos para determinar en qué parte del cuerpo se ha producido el daño. Las comparaciones con la ALT han resultado especialmente útiles para identificar daños en el hígado como la cirrosis y la hepatitis. En condiciones normales, los niveles de AAT en los hombres son de 6-34 UI/L y en las mujeres de 8-40 UI/L.
Estructuras 3D de la aspartato aminotransferasa
Estructuras 3D de la aspartato aminotransferasa