La sección anterior muestra cómo los diferentes elementos pueden existir solos o combinarse con otros elementos para formar compuestos. Esta sección se basa en estas ideas al ver las reacciones químicas con más detalle. También muestra cómo la taquigrafía química puede ampliarse para describir las reacciones químicas.
En primer lugar, considera algunas de las moléculas descritas anteriormente: agua, metano, dióxido de carbono y amoníaco.
Pregunta 26
¿Cuáles son las fórmulas de cada una de estas cuatro moléculas?
Respuesta
Las fórmulas son H2O, CH4, CO2 y NH3, respectivamente.
Aunque no es necesario que recuerdes las fórmulas químicas de los compuestos introducidos en este curso, probablemente te será útil memorizar algunas como las de las cuatro moléculas anteriores, además de las de las moléculas de hidrógeno (H2), nitrógeno (N2) y oxígeno (O2). Esto te ayudará a leer y escribir estas fórmulas químicas sin tener que remitirte continuamente a las secciones anteriores.
Ahora verás las reacciones en las que intervienen los elementos hidrógeno, carbono y oxígeno y los compuestos metano, agua y dióxido de carbono.
El hidrógeno reacciona con el oxígeno cuando se enciende (es bastante explosivo) para formar agua. Para escribir una reacción de este tipo en términos de una ecuación química, las sustancias que sufren la reacción se ponen a la izquierda y las sustancias que se producen en la reacción se ponen a la derecha. Los reactivos de la izquierda están unidos a los productos de la derecha por una flecha.
La ecuación puede escribirse como una ecuación verbal «el hidrógeno y el oxígeno hacen agua» o, utilizando un poco de taquigrafía química, puede escribirse como:

donde la flecha significa «va a».
Ahora, intenta utilizar la taquigrafía química para escribir la ecuación. Sustituyendo los símbolos en la palabra ecuación se obtiene:

La ecuación muestra que los reactivos de la izquierda de la flecha se convierten en el producto de la derecha. Sin embargo, hay algo que falla en esta ecuación. Puedes ver lo que falla observando la Figura 21, donde los reactantes y los productos se muestran en forma de diagrama.
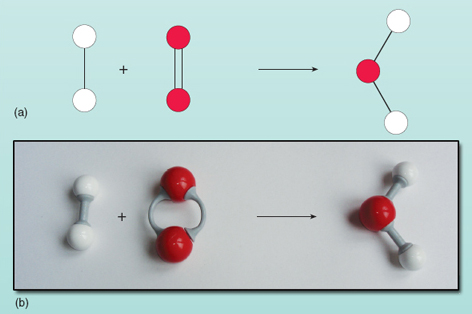
Contando el número de átomos en cada lado de la ecuación se ve que hay dos átomos de oxígeno a la izquierda en comparación con uno a la derecha. El número de átomos de oxígeno en ambos lados de la ecuación debe ser igual – no pueden aparecer y desaparecer mágicamente durante una reacción. No es posible cambiar la composición de la molécula de agua a la derecha de la ecuación, ya que la molécula de agua existe como un grupo de dos átomos de hidrógeno y un átomo de oxígeno unidos entre sí. Cada molécula de oxígeno aporta dos átomos de oxígeno, por lo que siempre formará dos moléculas de agua, siempre que haya dos moléculas de hidrógeno (cada una es una unidad de dos átomos) para reaccionar con ella. Por tanto, se necesitan dos moléculas de hidrógeno y una de oxígeno para formar dos moléculas de agua. La reacción se expresa con exactitud de la siguiente manera:

Ahora hay el mismo número de cada tipo de átomo en ambos lados de la ecuación: la ecuación química está equilibrada, por lo que ahora podemos sustituir la flecha por un signo de igualdad.
Un último ajuste para evitar la repetición de las moléculas de hidrógeno a la izquierda de la ecuación y de las moléculas de agua a la derecha es representarlas por 2H2 en lugar de H2 + H2. Así, la ecuación química equilibrada pasa a ser:

Esto se muestra en forma de diagrama en la Figura 22.

Las ecuaciones químicas muestran de forma muy concisa no sólo qué átomos y moléculas reaccionan juntos para formar los productos, sino también cuántos de cada tipo de átomo y molécula están involucrados. Es importante recordar que el número que precede a una molécula significa el número de esa molécula en particular. Por ejemplo, 3H2O significa tres moléculas de agua, lo que da un total de seis átomos de hidrógeno y tres de oxígeno.
Las ecuaciones químicas deben estar equilibradas; el número de átomos de cada tipo de elemento en ambos lados de la ecuación debe ser igual.
Ahora ya sabes cómo «leer» o interpretar una ecuación química, y cómo representa un proceso químico. Sin embargo, los químicos también son muy hábiles en la escritura de ecuaciones químicas como una forma de taquigrafía para describir varios procesos o reacciones químicas. Escribir ecuaciones químicas es como escribir en cualquier idioma extranjero: requiere práctica para adquirir soltura. Sin embargo, todos los científicos en ciernes tienen que empezar por algún sitio y en la sección siguiente se muestra cómo hacerlo utilizando una reacción química muy conocida. Si quieres comprobar si necesitas estudiar esta sección, prueba primero con la pregunta 20.