Descripción en reacciones químicas
En este capítulo, aprenderemos sobre algunas reacciones en las que los pasos clave implican el movimiento de electrones individuales. Tal vez recuerde de la sección 6.1A que el movimiento de un solo electrón se representa con una flecha de «anzuelo» de una sola barra (a diferencia de las conocidas flechas de doble barra que hemos estado utilizando a lo largo del libro para mostrar el movimiento de dos electrones).

Los mecanismos de un solo electrón implican la formación y posterior reacción de especies de radicales libres, intermediarios altamente inestables que contienen un electrón no apareado. Aprenderemos en este capítulo cómo los radicales libres se forman a menudo a partir de la escisión homolítica, un evento en el que los dos electrones de un enlace covalente que se rompe se mueven en direcciones opuestas.

(En contraste, esencialmente todas las reacciones que hemos estudiado hasta ahora implican eventos de ruptura de enlaces en los que ambos electrones se mueven en la misma dirección: esto se llama escisión heterolítica).
También aprenderemos que muchos mecanismos de un solo electrón adoptan la forma de una reacción radical en cadena, en la que un radical provoca la formación de un segundo radical, que a su vez provoca la formación de un tercer radical, y así sucesivamente.
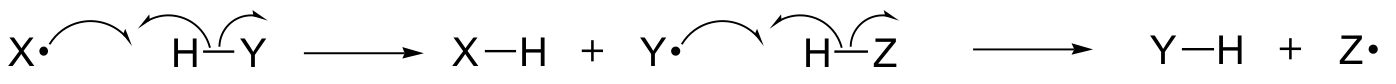
La alta reactividad de las especies de radicales libres y su capacidad para iniciar reacciones en cadena es a menudo beneficiosa: aprenderemos en este capítulo sobre las reacciones de polimerización de radicales que forman materiales útiles como el plexiglás y el tejido de polipropileno. También aprenderemos sobre las reacciones radicales que son perjudiciales, como la degradación del ozono atmosférico por el freón, y el daño oxidativo causado a los lípidos y al ADN en nuestro cuerpo por las especies de radicales libres. Por último, veremos cómo algunas enzimas utilizan metales ligados para catalizar altas e
La geometría y la estabilidad relativa de los radicales de carbono
Como químicos orgánicos, nos interesan especialmente los radicales intermedios en los que el electrón no apareado reside en un átomo de carbono. Las pruebas experimentales indican que los tres enlaces de un radical de carbono tienen una geometría planar trigonal y, por lo tanto, se considera que el carbono está hibridado sp2 con el electrón no apareado ocupando el 2pzorbital perpendicular y no hibridado. Contrasta esta imagen con los intermedios carbocatión y carbanión, que también son trigonalmente planares pero cuyos orbitales 2pz contienen cero o dos electrones, respectivamente.

La tendencia en la estabilidad de los radicales de carbono es paralela a la de los carbocatiónes (sección 8.4B): los radicales terciarios, por ejemplo, son más estables que los secundarios, seguidos de los primarios y los metílicos. Esto debería tener un sentido intuitivo, porque los radicales, al igual que los carbocationes, pueden considerarse deficientes en electrones y, por lo tanto, se estabilizan por los efectos de donación de electrones de los grupos alquilos cercanos. Los radicales benzílicos y alílicos son más estables que los radicales alquílicos debido a los efectos de resonancia: un electrón no apareado puede deslocalizarse sobre un sistema de enlaces pi conjugados. Un radical alílico, por ejemplo, puede representarse como un sistema de tres orbitales 2pz paralelos que comparten tres electrones.
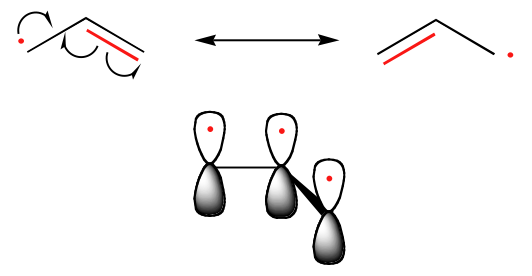
Tendencias en la estabilidad de los radicales
Alílicos &Bencílicos > 3o > 2o > 1o > Metil

En esta molécula, la ya extensa estabilización de resonancia se ve reforzada por la capacidad de los átomos de cloro de proteger el centro radical de los reactivos externos. El radical está, en cierto sentido, dentro de una «jaula» protectora.
Química orgánica con énfasis biológico por Tim Soderberg (Universidad de Minnesota, Morris)
-
Prof. Steven Farmer (Universidad Estatal de Sonoma)
- Layne A. Morsch (Universidad de Illinois Springfield)