Aspartate Aminotransférase par Luke Spooner
Contenu
- 1 Fonction
- 2 Structure
- 3 Fonction
- 4 Applications cliniques
- 5 Structures 3D de l’aspartate aminotransférase
.
Fonction
Aspartate Aminotransférase (AAT), également connue sous le nom de transaminase glutamique aspartique, transaminase glutamique oxaloacétique, préphénate aminotransférase et transaminase A est une enzyme membre de la famille des aminotransférases pyridoxal-phosphate-dépendantes de classe I . Elle est codée par le gène GOT1. Il s’agit d’un homodimère de 413 acides aminés qui joue un rôle essentiel dans le métabolisme des acides aminés et des glucides, l’uréogenèse et le transfert des équivalents réducteurs dans la mitochondrie et le chloroplaste. Dans les cellules procaryotes, elle se trouve exclusivement dans le cytosol, mais dans les cellules eucaryotes, il existe des isozymes du cytosol, de la mitochondrie et du chloroplaste. L’aspartate aminotransférase bifonctionnelle (BAAT) est nécessaire pour la transamination du préphanate en arogénate.
Dans le corps humain, elle est produite dans le cerveau, les muscles squelettiques, le foie, le pancréas, les globules rouges et les reins . Le large éventail de tissus dans lesquels elle est fabriquée, la sépare de l’enzyme similaire alanine transaminase (ALT) qui se trouve principalement dans le foie. Le taux d’AAT dans l’organisme peut être utilisé comme marqueur de maladies ou de lésions tissulaires. De même, les taux d’AAT et d’ALT peuvent être comparés pour déterminer avec précision si les lésions tissulaires se trouvent principalement dans le foie.
Structure
qui contient (hélices alpha, brins bêta, boucles, tours). Unité asymétrique de l’Aspartate aminotransférase, avec petit et grand domaine mis en évidence et cofacteur PLP (1b4x). Chaque sous-unité contient un site actif équivalent. Les sous-unités se connectent en deux endroits : entre leurs grands domaines et entre les résidus N-terminaux et le grand domaine de l’autre sous-unité. Cette structure de l’AST varie de façon infime entre les organismes, de E. coli à l’homme. De même, la structure du site actif est hautement conservée avec une homologie de séquence de 25%.
Chaque sous-unité de l’homodimère est en outre divisée en un petit et un grand domaine. Le est composé des acides aminés de l’extrémité N-terminale au résidu Pro 48 et de Met 326 à l’extrémité C-terminale. Les acides aminés restants constituent le , et le sont reliés par une longue hélice α composée de 32 acides aminés.
Le grand domaine est l’endroit où se trouve le site actif de l’AAT et pour l’accueillir, le noyau contient de nombreuses structures α/β supersecondaires. Ceci contraste avec le noyau de la petite sous-unité qui est formé de deux α-hélices et de deux β-brins. Dans les organismes multicellulaires, il y a un coude au niveau du 325e résidu qui agit comme une charnière pour le petit domaine, ce qui permet les changements conformationnels résultants qui ont lieu lors de la liaison des inhibiteurs à l’enzyme.
Comme cela a été dit plus haut, le site actif de l’AST est situé sur le grand domaine de la sous-unité. Dans le site actif se trouve le résidu aminé Lys 258, également connu sous le nom d’aldimine interne, qui se lie au cofacteur Pyridoxal 5′-phosphate () en formant ce qu’on appelle une base de Schiff. Lors de l’ajout d’un substrat d’acide aminé, une nouvelle base de Schiiff se forme entre le PLP et l’acide aminé.
Fonction
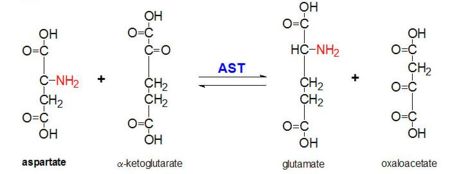
Figure 2 : Réaction de transamination de L-aspartate et d’α-cétoglutarate catalysée par l’aspartate aminotransférase
L’AAT catalyse la transamination réversible du groupe α-amino de L-aspartate en α-cétoglutarate formant de l’oxaloacétate et du glutamate. Cette réactivité est plus faible chez E.coli que chez les eucaryotes supérieurs, et présente une spécificité de substrat plus large. Cependant, la réaction se déroule de la même manière. Lors de l’introduction d’un substrat d’acide aminé, une nouvelle base de Schiff se forme entre celui-ci et le cofacteur PLP. L’acide aminé perd alors un hydrogène et forme un intermédiaire quinoïde, et une reprotanation a lieu, donnant lieu à une cétimine. Ensuite, la structure est hydrolysée en formant un α-cétoacide et du phosphate de pyridoxamine. Le 2-méthyl aspartate agit comme un inhibiteur de l’AAT lorsqu’il forme une base de Schiif avec le cofacteur PLP, plutôt que l’aspartate. Cela entraîne l’arrêt du processus à l’étape précédant l’élimination de la protéine alpha.
Cette réaction est essentielle au maintien de l’homéostasie des organismes. Les quatre différentes molécules qui peuvent se former à la suite de cette transanimation (oxaloacétate, α-cétoglutarate, aspartate, L-glutamate) nos critiques à un certain nombre de processus métaboliques. L’oxaloacétate et l’α-cétoglutarate jouent un rôle critique dans le cycle de Krebs, les formes variables d’aspartate sont des molécules importantes dans le cycle de l’urée et participent à la néoglucogenèse, et le glutamate est une molécule importante dans les voies métaboliques associées à la mémoire.
Applications cliniques
Les niveaux d’AAT dans le corps sont indicatifs de dommages tissulaires et de maladies. Normalement, l’AAT se trouve en quantité minime dans le sang, cependant lorsque les organes mentionnés ci-dessus sont endommagés, l’AAT est libérée dans le sang. La quantité libérée est proportionnelle au niveau de l’atteinte subie. Il a été démontré que le taux d’AAT augmente considérablement dans les 6 heures suivant la dégradation initiale des tissus et peut rester élevé jusqu’à 4 jours. Les médecins peuvent utiliser les taux d’AAT, comparés aux taux d’autres enzymes, pour déterminer à quel endroit de l’organisme les lésions se sont produites. Les comparaisons avec l’ALT se sont révélées particulièrement utiles pour identifier les lésions hépatiques telles que la cirrhose et l’hépatite. Dans des conditions normales, les niveaux d’AAT chez les hommes sont de 6-34 UI/L et chez les femmes de 8-40 UI/L.
Structures 3D de l’aspartate aminotransférase
Structures 3D de l’aspartate aminotransférase
.