Nommer les alcools
- Trouver la chaîne la plus longue contenant le groupe hydroxy (OH). S’il y a une chaîne avec plus de carbones que celle contenant le groupe OH, elle sera nommée comme un subsituant.
- Placez le OH sur le numéro le plus bas possible pour la chaîne. A l’exception des groupes carbonyles tels que les cétones et les aldéhydes, les groupes alcools ou hydroxy ont la première priorité pour la dénomination.
- Lors de la dénomination d’une structure cyclique, le -OH est supposé être sur le premier carbone à moins que le groupe carbonyle soit présent, auquel cas ce dernier aura la priorité sur le premier carbone.
- Lorsque plusieurs groupes -OH sont sur la structure cyclique, numéroter les carbones sur lesquels les groupes -OH résident.
- Supprimer le e final de la chaîne de l’alcane parent et ajouter -ol. Lorsque plusieurs alcools sont présents, utilisez di, tri, et.c avant l’ol, après le nom du parent. ex. 2,3-hexandiol. Si un groupe carbonyle est présent, le groupe -OH est nommé avec le préfixe « hydroxy », avec le groupe carbonyle attaché au nom de la chaîne parentale de sorte qu’il se termine par -al ou -one.
Exemples
Ethane : CH3CH3 —–>Ethanol : 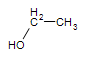 (l’alcool que l’on trouve dans la bière, le vin et les autres spiritueux consommés)
(l’alcool que l’on trouve dans la bière, le vin et les autres spiritueux consommés)
Alcool secondaire : 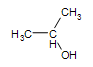 2-propanol
2-propanol
Autres groupes fonctionnels sur un alcool : 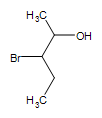 3-bromo-2-pentanol
3-bromo-2-pentanol
Alcool cyclique (deux groupes -OH) : 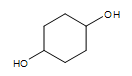 cyclohexan-1,4-diol
cyclohexan-1,4-diol
Autre groupe fonctionnel sur la structure cyclique : 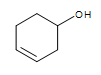 3-hexénol (l’alcène est en gras et indiqué par la numérotation du carbone le plus proche de l’alcool)
3-hexénol (l’alcène est en gras et indiqué par la numérotation du carbone le plus proche de l’alcool)
Un alcool complexe :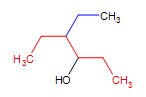 4-éthyl-3hexanol (la chaîne mère est en rouge et le substituant en bleu)
4-éthyl-3hexanol (la chaîne mère est en rouge et le substituant en bleu)
Dans le système de nomenclature de l’UICPA, les groupes fonctionnels sont normalement désignés de l’une des deux manières suivantes. La présence de la fonction peut être indiquée par un suffixe caractéristique et un numéro d’emplacement. C’est le cas des doubles et triples liaisons carbone-carbone qui ont les suffixes respectifs -ene et -yne. Les halogènes, par contre, n’ont pas de suffixe et sont nommés comme substituants, par exemple : (CH3)2C=CHCHClCH3 est le 4-chloro-2-méthyl-2-pentène.
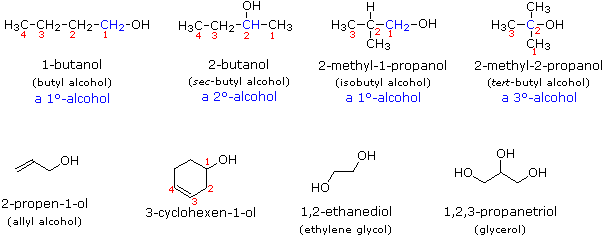
Les alcools sont généralement nommés selon la première procédure et sont désignés par un suffixe -ol, comme dans l’éthanol, CH3CH2OH (notez qu’un numéro de localisation n’est pas nécessaire sur une chaîne à deux carbones). Sur les chaînes plus longues, l’emplacement du groupe hydroxyle détermine la numérotation de la chaîne. Par exemple : (CH3)2C=CHCH(OH)CH3 est le 4-méthyl-3-pentène-2-ol. D’autres exemples de la nomenclature UICPA sont présentés ci-dessous, ainsi que les noms communs souvent utilisés pour certains des composés les plus simples. Pour les alcools mono-fonctionnels, ce système commun consiste à nommer le groupe alkyle suivi du mot alcool. Les alcools peuvent également être classés comme primaires, 1º, secondaires, 2º, et tertiaires, 3º, de la même manière que les halogénures d’alkyle. Cette terminologie fait référence à la substitution alkyle de l’atome de carbone portant le groupe hydroxyle (coloré en bleu dans l’illustration).
Plusieurs groupes fonctionnels ont un désignateur suffixe caractéristique, et un seul de ces suffixes (autre que « -ène » et « -yne ») peut être utilisé dans un nom. Lorsque le groupe fonctionnel hydroxyle est présent avec une fonction de priorité plus élevée dans la nomenclature, il doit être cité et localisé par le préfixe hydroxy et un numéro approprié. Par exemple, l’acide lactique a le nom IUPAC d’acide 2-hydroxypropanoïque.
Nommer les éthers
Les éthers sont des composés ayant deux groupes alkyle ou aryle liés à un atome d’oxygène, comme dans la formule R1-O-R2. Le groupe fonctionnel éther ne possède pas de suffixe caractéristique de la nomenclature UICPA, il est donc nécessaire de le désigner comme un substituant. Pour ce faire, les substituants alcoxy courants reçoivent des noms dérivés de leur composant alkyle (ci-dessous) :
| Groupe alkyle | Nom | Groupe alcoxy | Nom | |
|---|---|---|---|---|
| CH3- | Méthyle | CH3O- | Méthoxy | |
| CH3CH2- | Ethyle | CH3CH2O- | Ethoxy | |
| (CH3)2CH- | Isopropyl | (CH3)2CHO- | Isopropoxy | |
| (CH3)3C- | tert-…Butyl | (CH3)3CO- | tert-Butoxy | |
| C6H5- | Phényle | C6H5O- | Phénoxy |
Le plus petit, le groupe alkyle le plus court devient le substituant alcoxy. Le côté du groupe alkyle plus grand et plus long devient le nom de la base alcane. Chaque groupe alkyle de chaque côté de l’oxygène est numéroté séparément. La priorité de numérotation est donnée au carbone le plus proche de l’oxygène. Le côté alcoxy (côté le plus court) a une terminaison « -oxy » avec son groupe alkyle correspondant. Par exemple, CH3CH2CH2CH2CH2-O-CH2CH2CH3 est le 1-propoxypentane. S’il y a une stéréochimie cis ou trans, la même règle s’applique toujours.
Exemple 9.3.1
Les exemples sont : CH3CH2OCH2CH3, éther diéthylique (parfois appelé éther), et CH3OCH2CH2OCH3, éther diméthylique d’éthylène glycol (glyme).
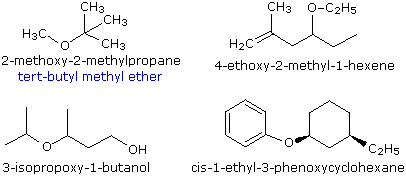
Noms communs
Les éthers simples reçoivent des noms communs dans lesquels les groupes alkyles liés à l’oxygène sont nommés par ordre alphabétique suivis du mot « éther ». L’exemple en haut à gauche montre le nom commun en bleu sous le nom IUPAC. De nombreux éthers simples sont symétriques, en ce sens que les deux substituants alkyle sont identiques. Ils sont nommés « éthers dialkyliques ».
Hétérocycles
Dans les éthers cycliques (hétérocycles), un ou plusieurs carbones sont remplacés par de l’oxygène. On parle souvent d’hétéroatomes, lorsque le carbone est remplacé par un oxygène ou tout autre atome que le carbone ou l’hydrogène. Dans ce cas, la tige est appelée oxacycloalcane, où le préfixe « oxa- » est un indicateur du remplacement du carbone par un oxygène dans le cycle. Ces composés sont numérotés en commençant par l’oxygène et en continuant autour du cycle. Par exemple,

Si un substituant est un alcool, l’alcool a une priorité plus élevée. Cependant, si un substituant est un halogénure, l’éther a une priorité plus élevée. S’il y a à la fois un groupe alcool et un halogénure, l’alcool a une priorité plus élevée. La numérotation commence par l’extrémité la plus proche du substituant de priorité supérieure. Il existe des éthers qui contiennent plusieurs groupes éther et qui sont appelés polyéthers cycliques ou éthers couronnes. Ces derniers sont également nommés selon le système UICPA.
sulfure d’éthyle. Les sulfures sont chimiquement plus réactifs que les éthers, reflétant la plus grande nucléophilie du soufre par rapport à l’oxygène.
Problèmes
Nommer les éthers suivants:
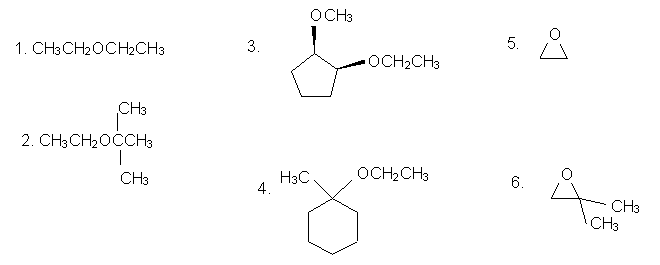
(Réponses aux problèmes ci-dessus : 1. Éther diéthylique ; 2. 2-éthoxy-2-méthyl-1-propane ; 3. cis-1-éthoxy-2-méthoxycyclopentane ; 4. 1-éthoxy-1-méthylcyclohexane ; 5. oxacyclopropane ; 6. 2,2-Diméthyloxacyclopropane)
Noms communs de certains éthers
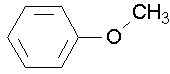
anisole (essayez de nommer l’anisole par les deux autres conventions. J )
oxirane
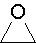
1,2-époxyéthane, oxyde d’éthylène, oxyde de diméthylène, oxacyclopropane,
furane (ce composé est aromatique)
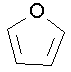
tétrahydrofurane

oxacyclopentane, 1,4-époxybutane, oxyde de tétraméthylène,
dioxane

1,4-dioxacyclohexane
Contributeurs
- Abhiram Kondajji (UCD)
-
William Reusch, professeur émérite (Michigan State U.), Manuel virtuel de chimie organique
.