Depiction dans les réactions chimiques
Dans ce chapitre, nous allons découvrir certaines réactions dans lesquelles les étapes clés impliquent le mouvement d’électrons uniques. Vous vous rappelez peut-être, en remontant à la section 6.1A, que le mouvement des électrons simples est représenté par une flèche » en hameçon » à une seule barbe (par opposition aux flèches familières à double barbe que nous avons utilisées tout au long du livre pour montrer le mouvement des deux électrons).

Les mécanismes à électron unique impliquent la formation et la réaction subséquente d’espèces radicalaires, des intermédiaires hautement instables qui contiennent un électron non apparié. Nous apprendrons dans ce chapitre comment les radicaux libres sont souvent formés à partir d’un clivage homolytique, un événement où les deux électrons d’une liaison covalente en rupture se déplacent dans des directions opposées.

(En revanche, essentiellement toutes les réactions que nous avons étudiées jusqu’à présent impliquent des événements de rupture de liaison dans lesquels les deux électrons se déplacent dans la même direction : on parle de clivage hétérolytique).
Nous apprendrons également que de nombreux mécanismes à électron unique prennent la forme d’une réaction en chaîne radicalaire, dans laquelle un radical entraîne la formation d’un deuxième radical, qui à son tour entraîne la formation d’un troisième radical, et ainsi de suite.
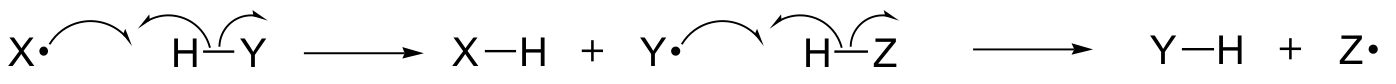
La grande réactivité des espèces radicalaires et leur capacité à initier des réactions en chaîne est souvent bénéfique – nous apprendrons dans ce chapitre les réactions de polymérisation radicalaire qui forment des matériaux utiles tels que le plexiglas et le tissu de polypropylène. Nous découvrirons également les réactions radicalaires qui sont nuisibles, comme la dégradation de l’ozone atmosphérique par le fréon, et les dommages oxydatifs causés aux lipides et à l’ADN dans notre corps par les espèces radicalaires. Enfin, nous verrons comment certaines enzymes utilisent des métaux liés pour catalyser des e
La géométrie et la stabilité relative des radicaux de carbone
En tant que chimistes organiques, nous sommes particulièrement intéressés par les intermédiaires radicaux dans lesquels l’électron non apparié réside sur un atome de carbone. Les preuves expérimentales indiquent que les trois liaisons dans un radical de carbone ont une géométrie planaire trigonale, et donc le carbone est considéré comme étant hybridé sp2 avec l’électron non apparié occupant la 2pzorbital perpendiculaire et non hybridée. Contrastez cette image avec les intermédiaires carbocation et carbanion, qui sont tous deux également trigonal planaire mais dont les orbitales 2pz contiennent zéro ou deux électrons, respectivement.

La tendance de la stabilité des radicaux carbonés est parallèle à celle des carbocations (section 8.4B) : les radicaux tertiaires, par exemple, sont plus stables que les radicaux secondaires, suivis des radicaux primaires et méthyles. Cela devrait avoir un sens intuitif, car les radicaux, comme les carbocations, peuvent être considérés comme déficients en électrons, et sont donc stabilisés par les effets donneurs d’électrons des groupes alkyles voisins. Les radicaux benzyliques et allyliques sont plus stables que les radicaux alkyles en raison des effets de résonance – un électron non apparié peut être délocalisé sur un système de liaisons pi conjuguées. Un radical allylique, par exemple, peut être représenté comme un système de trois orbitales 2pz parallèles partageant trois électrons.
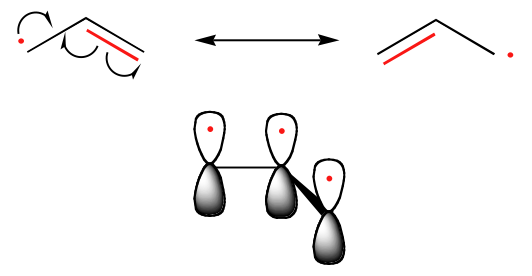
Tendances de la stabilité des radicaux
Allyque & Benzlique > 3o > 2o > 1o > Méthyle

Dans cette molécule, la stabilisation de résonance déjà importante est encore renforcée par la capacité des atomes de chlore à protéger le centre du radical des réactifs externes. Le radical est, en quelque sorte, à l’intérieur d’une « cage » protectrice.
Chimie organique avec une emphase biologique par Tim Soderberg (Université du Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (Université de l’Illinois Springfield)
.