Poprzednia sekcja pokazuje jak różne pierwiastki mogą istnieć samodzielnie lub łączyć się z innymi pierwiastkami tworząc związki. Ta sekcja opiera się na tych pomysłach, patrząc na reakcje chemiczne w sposób bardziej szczegółowy. Pokazuje również, jak skróty chemiczne mogą być rozszerzone do opisywania reakcji chemicznych.
Po pierwsze, rozważ niektóre z cząsteczek opisanych wcześniej: wodę, metan, dwutlenek węgla i amoniak.
Pytanie 26
Jakie są wzory dla każdej z tych czterech cząsteczek?
Odpowiedź
Są to odpowiednio H2O, CH4, CO2 i NH3.
Pomimo że nie musisz pamiętać wzorów chemicznych związków wprowadzonych w tym kursie, prawdopodobnie przyda Ci się zapamiętanie kilku z nich, takich jak te dla czterech powyższych cząsteczek oraz te dla cząsteczek wodoru (H2), azotu (N2) i tlenu (O2). To pomoże ci w czytaniu i pisaniu tych wzorów chemicznych bez ciągłego odwoływania się do poprzednich rozdziałów.
Teraz przyjrzysz się reakcjom z udziałem pierwiastków: wodoru, węgla i tlenu oraz związków: metanu, wody i dwutlenku węgla.
Wodór będzie reagował z tlenem, gdy zostanie zapalony (jest dość wybuchowy), tworząc wodę. Aby zapisać taką reakcję w postaci równania chemicznego, po lewej stronie umieszczamy substancje, które ulegają reakcji, a po prawej substancje, które powstają w tej reakcji. Reagenty po lewej stronie są połączone strzałką z produktami po prawej stronie.
Równanie to można zapisać jako równanie słowne „wodór i tlen tworzą wodę” lub, używając skrótu chemicznego, można je zapisać jako:

gdzie strzałka oznacza „idzie do”.
Teraz spróbuj użyć skrótu chemicznego do napisania równania. Zastąpienie symboli w słowie równanie daje:

Równanie pokazuje, że reaktanty po lewej stronie strzałki są przekształcane w produkt po prawej stronie. Jednak coś jest nie tak z tym równaniem. Możesz zobaczyć, co jest nie tak, patrząc na rysunek 21, gdzie reaktanty i produkty są przedstawione w postaci diagramu.
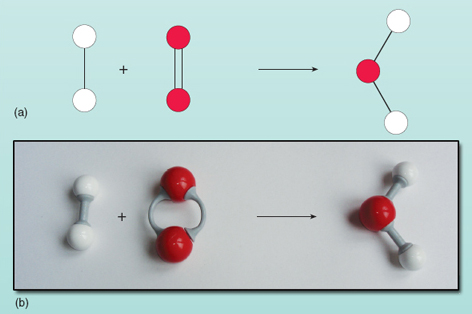
Licząc liczbę atomów po każdej stronie równania widać, że po lewej stronie są dwa atomy tlenu, a po prawej jeden. Liczba atomów tlenu po obu stronach równania musi być równa – nie mogą one w magiczny sposób pojawiać się i znikać podczas reakcji. Nie jest możliwa zmiana składu cząsteczki wody po prawej stronie równania, ponieważ cząsteczka wody istnieje jako grupa dwóch atomów wodoru i jednego atomu tlenu, połączonych ze sobą. Każda cząsteczka tlenu dostarcza dwóch atomów tlenu, więc zawsze będzie tworzyć dwie cząsteczki wody, pod warunkiem, że istnieją dwie cząsteczki wodoru (każda jest jednostką dwóch atomów), które z nią reagują. Tak więc do utworzenia dwóch cząsteczek wody potrzebne są dwie cząsteczki wodoru i jedna cząsteczka tlenu. Reakcja jest dokładnie wyrażona przez:

Po obu stronach równania są teraz takie same liczby atomów każdego typu: równanie chemiczne jest zrównoważone, więc możemy teraz zastąpić strzałkę znakiem równości.
Ostatnie uporządkowanie, aby uniknąć powtórzenia cząsteczek wodoru po lewej stronie równania i cząsteczek wody po prawej, polega na przedstawieniu ich jako 2H2, a nie H2 + H2. Tak więc zrównoważone równanie chemiczne staje się:

Jest to pokazane schematycznie na Rysunku 22.

Równania chemiczne pokazują w bardzo zwięzły sposób nie tylko, które atomy i cząsteczki reagują ze sobą, tworząc produkty, ale także ile każdego rodzaju atomu i cząsteczki bierze udział w reakcji. Ważne jest, aby pamiętać, że liczba przed cząsteczką oznacza liczbę tej konkretnej cząsteczki. Na przykład 3H2O oznacza trzy cząsteczki wody, co daje w sumie sześć atomów wodoru i trzy atomy tlenu.
Równania chemiczne muszą się równoważyć; liczba atomów każdego typu pierwiastka po obu stronach równania musi być równa.
Teraz wiesz, jak „czytać” lub interpretować równanie chemiczne – i jak przedstawia ono proces chemiczny. Jednak chemicy są również bardzo biegli w pisaniu równań chemicznych jako formy skrótu do opisywania różnych procesów lub reakcji chemicznych. Pisanie równań chemicznych jest jak pisanie w jakimkolwiek obcym języku – wymaga praktyki, aby stać się płynnym. Wszyscy początkujący naukowcy muszą jednak od czegoś zacząć, a poniższy rozdział pokazuje, jak to zrobić na przykładzie bardzo dobrze znanej reakcji chemicznej. Jeśli chcesz sprawdzić, czy musisz się uczyć tej sekcji, spróbuj najpierw odpowiedzieć na pytanie 20.
.