- Trójtlenek siarki Właściwości chemiczne, zastosowania, produkcja
- Właściwości chemiczne
- Właściwości fizyczne
- Metody produkcji
- Opis ogólny
- powietrze &woda Reakcje
- Profil reaktywności
- Niebezpieczeństwo
- Zagrożenie dla zdrowia
- Zagrożenie pożarowe
- Profil bezpieczeństwa
- Potencjalne narażenie
- składowanie
- Wysyłka
- Niezgodności
- Usuwanie odpadów
Trójtlenek siarki Właściwości chemiczne, zastosowania, produkcja
Właściwości chemiczne
Trójtlenek siarki, S03, znany również jako bezwodnik siarkowy, igły lub polimer, istnieje w wielu modyfikacjach, które różnią się gatunkiem cząsteczki i formą krystaliczną. Ma białą, lodopodobną modyfikację, która topi się w temperaturze 16°C (61°F) i dwie inne formy podobne do bestosu, które topią się w wyższych temperaturach 33 i 62°C (90 i 144°F). Bezbarwna postać ciekła lub gazowa ma drażniące, toksyczne opary i wrze w temperaturze 45 °C (112 °F).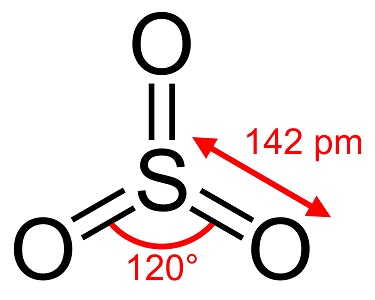
Trójtlenek siarki jest wysoce reaktywną substancją, silnym utleniaczem i stanowi zagrożenie pożarowe. Reaguje z tlenkami metali, tworząc siarczany, oraz z wodą, tworząc kwas siarkowy. Trójtlenek siarki jest używany do sulfonowania.
Właściwości fizyczne
Bezbarwna ciecz w temperaturze otoczenia i ciśnieniu atmosferycznym; dymy w powietrzu.
Trójtlenek siarki ma tendencję do polimeryzacji, szczególnie w obecności śladowych ilości wody lub kwasu siarkowego. Szybkość polimeryzacji, jednak zmniejsza się znacznie, jak jego temperatura zamarzania jest zbliża. Stały (polimeryczny) trójtlenek siarki istnieje w trzech fazach polimorficznych: alfa-, beta- i gamma- modyfikacje.
Faza alfa składa się z lodopodobnych igieł o polimerowej strukturze usieciowanej. Topi się w 62,3°C i ma ciśnienie pary 73 torr w 25°C.
Faza beta jest metastabilnym alotropem z białymi, podobnymi do azbestu, połyskliwymi igłami składającymi się z cząsteczek polimerowych, topi się w 32,5°C i ma ciśnienie pary 344 torr w 25°C.
Modyfikacja gamma w zwykłych temperaturach może występować w postaci stałej lub ciekłej. W postaci stałej jest to koloidalna masa podobna do lodu, topiąca się w temperaturze 16,8°C. W postaci ciekłej ma gęstość 1,9224 g/mL, wrze w temperaturze 44,8°C. Jego prężność par wynosi 433 torr w temperaturze 25°C. Faza gamma składa się zarówno z cyklicznych cząsteczek trimeru jak i monomeru. Podczas topnienia stały trójtlenek siarki przechodzi w fazę gamma, która po zestaleniu przechodzi w modyfikację alfa.
Temperatura krytyczna SO3 wynosi 217,8°C; ciśnienie krytyczne 80,97 atm; gęstość krytyczna 0,63 g/cm3; stała dielektryczna ciekłego SO3 w temperaturze 18°C wynosi 3,11.
Trójtlenek siarki rozpuszcza się w wodzie tworząc kwas siarkowy i wydzielając duże ilości ciepła.
Metody produkcji
Trójtlenek siarki jest wytwarzany jako półprodukt w produkcji kwasu siarkowego w procesie kontaktowym (Patrz: Kwas siarkowy). Proces ten obejmuje katalityczne utlenianie ditlenku siarki do tritlenku.
Tritlenek siarki jest przygotowywany w laboratorium przez ogrzewanie dymiącego kwasu siarkowego, skraplanie jego oparów i zbieranie w chłodnym zbiorniku. Kiedy pary są skraplane poniżej 27 ° C w obecności śladowej ilości wilgoci, wszystkie trzy fazy polimorficzne SO3 są produkowane. Można je rozdzielić za pomocą destylacji frakcyjnej. Kondensacja oparów powyżej 27°C tworzy ciekłą odmianę trójtlenku gamma-siarki.
Opis ogólny
Trójtlenek siarki jest bezbarwnym do białego krystalicznym ciałem stałym, które będzie dymić w powietrzu. Często dostarczany z inhibitorem, aby zapobiec polimeryzacji. Trójtlenek siarki gwałtownie reaguje z wodą, tworząc kwas siarkowy z wydzieleniem ciepła. Trójtlenek siarki jest żrący dla metali i tkanek. Trójtlenek siarki powoduje oparzenia oczu i skóry. Połknięcie powoduje poważne oparzenia jamy ustnej, przełyku i żołądka. Opary są bardzo toksyczne przy wdychaniu. Trójtlenek siarki stanowi zagrożenie pożarowe w kontakcie z materiałami organicznymi, takimi jak drewno, bawełna, płyty pilśniowe itp.
powietrze &woda Reakcje
Łączy się z wodą z siłą wybuchową, tworząc kwas siarkowy ze względu na swoją kwasowość Trójtlenek siarki zwęgla większość substancji organicznych. W kontakcie z powietrzem trójtlenek siarki szybko absorbuje wilgoć, wydzielając gęste, białe dymy.
Profil reaktywności
Reakcja trójtlenku siarki i difluorku tlenu jest bardzo energiczna i dochodzi do wybuchów, jeśli reakcja jest prowadzona w nieobecności rozpuszczalnika. Reakcja trójtlenku siarki w nadmiarze z tetrafluoroetylenem powoduje wybuchowy rozkład do fluorku karbonylu i dwutlenku siarki . Reakcja bezwodnego kwasu nadchlorowego z trójtlenkiem siarki jest gwałtowna i towarzyszy jej wydzielanie znacznego ciepła (Pascal 16:300 1931-34). Ciekły trójtlenek siarki reaguje gwałtownie z chlorkiem nitrylu, nawet w temperaturze 75° C. Reakcja trójtlenku siarki z tlenkiem ołowiu powoduje białą luminescencję. W połączeniu jodu, pirydyny, trójtlenku siarki i formamidu po kilku miesiącach powstaje gaz pod ciśnieniem. Wynika to z powolnego tworzenia się kwasu siarkowego, z wody zewnętrznej lub odwodnienia formamidu do cyjanowodoru.
Niebezpieczeństwo
Czynnik utleniający, ryzyko pożaru w kontakcie z materiałami nieorganicznymi, wybuchowy wzrost ciśnienia pary występuje, gdy forma α topi się. Bezwodnik łączy się z wodą, tworząc kwas siarkowy i wydzielając ciepło. Wysoce toksyczny, silnie drażniący dla tkanek.
Zagrożenie dla zdrowia
Trójtlenek siarki jest wysoce toksyczny. Jest drażniący i żrący dla błon śluzowych. Trujący w przypadku wdychania lub połknięcia. Kontakt powoduje poważne oparzenia skóry i oczu.
Zagrożenie pożarowe
Zagrożenie pożarowe w kontakcie z materiałami organicznymi. Wybuchowy wzrost ciśnienia pary występuje podczas topnienia formy alfa. Łączy się z wodą z gwałtownością wybuchową, tworząc kwas siarkowy. Może zapalić inne materiały palne (drewno, papier, olej, itp.). Łatwopalne trujące gazy mogą gromadzić się w zbiornikach i wagonach samowyładowczych. Spływ do kanalizacji może stwarzać zagrożenie pożarowe lub wybuchowe. W kontakcie z wodą tworzy kwas siarkowy. Unikać wody i materiałów organicznych. W kontakcie z powietrzem trójtlenek siarki absorbuje wilgoć i wydziela gęste, białe dymy.
Profil bezpieczeństwa
Trucizna przez drogi oddechowe. Ogólnoustrojowe skutki narażenia człowieka przez drogi oddechowe: kaszel i inne zmiany płucne i węchowe. Żrące działanie drażniące na skórę, oczy i błony śluzowe. Gwałtownie reaguje z O2F2, PbO, NClO2, HClO4, P, tetrafluoroetylenem, acetonitrylem, kwasem siarkowym, sulfotlenkiem dimetylu, dioksanem, wodą, rtęcią difenylowa, formamidem, jodem, pirydyną, tlenkami metali. Reaguje z parą wodną tworząc żrące, toksyczne opary kwasu siarkowego. Po podgrzaniu do rozkładu wydziela toksyczne dymy SO,. Patrz również KWAS SIARKOWY.
Potencjalne narażenie
Trójtlenek siarki jest stosowany jako środek sulfatyzujący i sulfonujący do detergentów, dodatków do olejów smarowych i innych związków organicznych; w kolektorach energii słonecznej. Jest również stosowany jako półprodukt w produkcji kwasu siarkowego oraz w produkcji materiałów wybuchowych.
składowanie
Ciśnienie pary trójtlenku siarki gwałtownie wzrasta wraz ze wzrostem temperatury, a gdy forma α topi się, wzrost ciśnienia jest wybuchowy; w związku z tym pojemniki do transportu i składowania muszą wytrzymywać ciśnienie 10-15 atm. Trójtlenek siarki reaguje energicznie i silnie egzotermicznie z wodą, tworząc kwas siarkowodorowy. W kontakcie z wilgotnym powietrzem wydziela opary i tworzy mgłę kwasu siarkowego, która w końcu wypełnia całą dostępną przestrzeń; powoduje również korozję metali. Jest silnym środkiem utleniającym, a w fazie ciekłej powoduje karbonizację materiałów organicznych.
Wysyłka
UN1829 Trójtlenek siarki, stabilizowany, Klasa zagrożenia: 8; Oznakowania: 8-Corrosive material, 6.1-Poisonous Inhalation Hazard, Inhalation Hazard Zone B.
Niezgodności
Palny i żrący. Silny utleniacz. Reaguje gwałtownie z wodą, parą wodną lub wilgocią, uwalniając żrący kwas siarkowodorowy. Gwałtowne reakcje występują w kontakcie z silnymi zasadami, silnymi kwasami, chemicznie aktywnymi metalami, środkami redukującymi, metalami drobno podzielonymi, cyjankami, azotanami, pikrynianami, piorunianami, chloranami, siarczkami, węglikami, fosforem, dwutlenkiem difluorku, tlenkiem baru, tlenkiem ołowiu, rtęcią difenylowa, alkoholami, chlorkiem nitrylu, acetonitrylem, dioksanem, tetrafluoroetylenem.
Usuwanie odpadów
Zwrócić dostawcy butle z gazem sprężonym nadające się do ponownego napełnienia. Butle nienadające się do ponownego napełnienia powinny być utylizowane zgodnie z przepisami lokalnymi, stanowymi i federalnymi. Pozwolić, aby pozostały gaz powoli ulatniał się do atmosfery w nie zamkniętym pomieszczeniu lub okapie wyciągowym. Butle nadające się do ponownego napełnienia powinny być zwrócone do dostawcy z zabezpieczonymi pokrywami zaworów i korkami wylotowymi oraz z założonymi pokrywami ochronnymi zaworów.