Struktura ta występuje, gdy dwa (lub więcej, np. ψ-pętla) segmenty łańcucha polipeptydowego zachodzą na siebie i tworzą ze sobą szereg wiązań wodorowych. Może to zachodzić w układzie równoległym:

lub w układzie antyrównoległym:
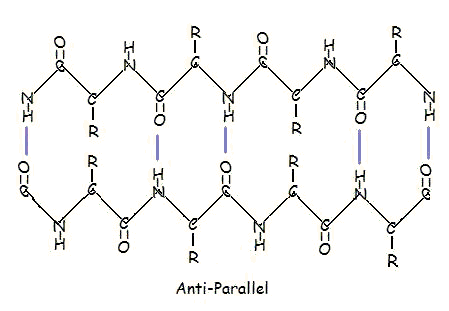
Układ równoległy i antyrównoległy jest bezpośrednią konsekwencją kierunkowości łańcucha polipeptydowego. W układzie antyrównoległym, koniec C-terminusa jednego segmentu znajduje się po tej samej stronie co koniec N-terminusa drugiego segmentu. W układzie równoległym, koniec C-terminusa i koniec N-terminusa obu segmentów znajdują się po tych samych stronach. Plisa” występuje z powodu naprzemiennych płaszczyzn wiązań peptydowych między aminokwasami; wyrównana grupa aminowa i karbonylowa każdego przeciwległego segmentu naprzemiennie zmieniają swoją orientację od zwróconych ku sobie do zwróconych w przeciwnych kierunkach.
Układ równoległy jest mniej stabilny, ponieważ geometria poszczególnych cząsteczek aminokwasów zmusza wiązania wodorowe do występowania pod kątem, przez co stają się one dłuższe, a tym samym słabsze. Przeciwnie, w układzie antyrównoległym wiązania wodorowe są ustawione bezpośrednio naprzeciwko siebie, dzięki czemu wiązania są silniejsze i bardziej stabilne.
Powszechnie, antyrównoległy arkusz beta-pleciony tworzy się, gdy łańcuch polipeptydowy gwałtownie odwraca kierunek. Może to nastąpić w obecności dwóch kolejnych reszt proliny, które tworzą kątowe załamanie w łańcuchu polipeptydowym i zginać go z powrotem na siebie. Nie jest to konieczne dla odległych segmentów łańcucha polipeptydowego, aby utworzyć beta-pleciony, ale dla segmentów bliższych jest to wymóg konieczny. W przypadku niewielkich odległości, dwa segmenty beta-plecionego arkusza są oddzielone 4+2n reszt aminokwasowych, przy czym 4 jest minimalną liczbą reszt.
.