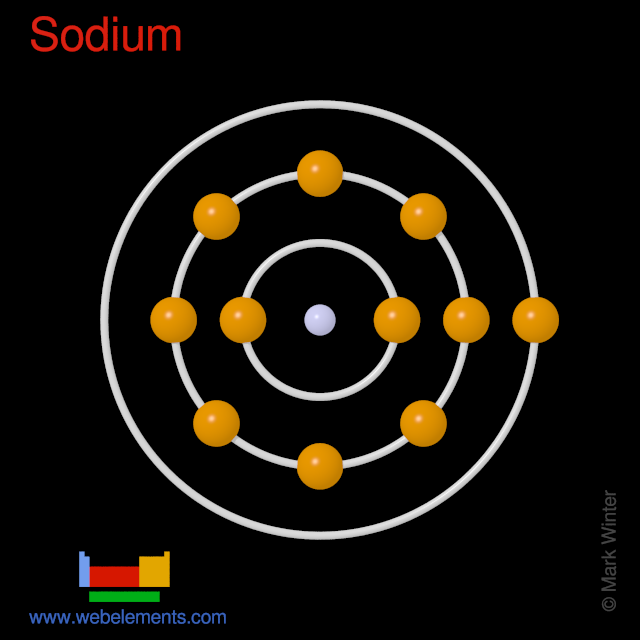
Atomy sodu mają 11 elektronów, a struktura powłokowa to 2,8,1.
Konfiguracja elektronowa stanu podstawowego gazowego neutralnego sodu to .3s1, a symbol terminu to 2S1/2.

Widmo atomowe
Oprezentacja widma atomowego sodu.
Energie jonizacji i powinowactwo elektronowe
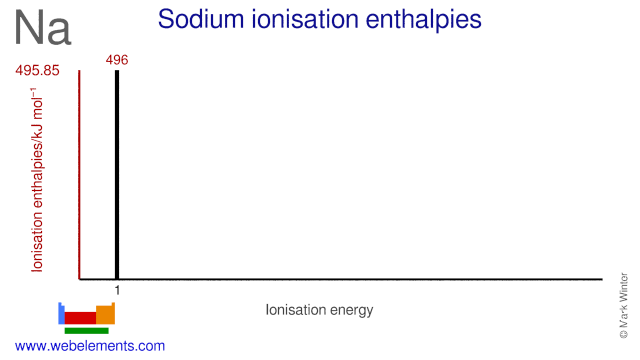
Stosunek do elektronów sodu wynosi 52,8 kJ mol-1. Energie jonizacji sodu są podane poniżej.
| Liczba energii jonizacji | Entalpia / kJ mol-1 |
|---|---|
| 1st | 495.85 |
| 2nd | 4562.44 |
| 3rd | 6910.28 |
| 4th | 9545.87 |
| 5-ta | 13354,0 |
| 6-ta | 16617.7 |
| 7-ta | 20117.6 |
| 8-ta | 25490.6 |
| 9-ta | 28931.7 |
| 10-ta | 141364 |
| 11-ta | 159076 |
Efektywne ładunki jądrowe
Następujące są „Clementi-Raimondi” efektywne ładunki jądrowe, Zeff. Podążaj za hiperłączami, aby uzyskać więcej szczegółów i wykresy w różnych formatach.
| 1s | 10.6259 | |||||||
|---|---|---|---|---|---|---|---|---|
| 2s | 6.57 | 2p | 6.80 | |||||
| 3s | 2.51 | 3p | (brak danych) | 3d | (brak danych) | |||
| 4s | (brak danych) | 4p | (brak danych) | 4d | (brak danych) | 4f | (brak danych) | |
| 5s | (brak danych) | 5p | (brak danych) | 5d | (brak danych) | |||
| 6s | (brak danych) | 6p | 6p | (brak danych) | ||||
| 7s | ||||||||
Te efektywne ładunki jądrowe, Zeff, zostały zaadaptowane z następujących źródeł:
- E. Clementi i D.L.Raimondi, J. Chem. Phys. 1963, 38, 2686.
- E. Clementi, D.L.Raimondi, and W.P. Reinhardt, J. Chem. Phys. 1967, 47, 1300.
Elektronowe energie wiązania
| Label | Orbital | eV |
|---|---|---|
| K | 1s | 1070.8 |
| L I | 2s | 63,5 |
| L II | 2p1/2 | 30,4 |
| L III | 2p3/2 | 30.5 |
Notatki
Jestem wdzięczny Gwynowi Williamsowi (Jefferson Laboratory, Virginia, USA), który dostarczył dane dotyczące energii wiązania elektronów. Dane te zostały zaadaptowane z odnośników 1-3. Są one tabelaryczne w innym miejscu na WWW (odnośnik 4) i w formie papierowej (odnośnik 5).
- J. A. Bearden i A. F. Burr, „Reevaluation of X-Ray Atomic Energy Levels”, Rev. Mod. Phys., 1967, 39, 125.
- M. Cardona i L. Ley, Eds., Photoemission in Solids I: General Principles (Springer-Verlag, Berlin) with additional corrections, 1978.
- Gwyn Williams WWW table of values
- D.R. Lide, (Ed.) in Chemical Rubber Company handbook of chemistry and physics, CRC Press, Boca Raton, Florida, USA, 81st edition, 2000.
- J. C. Fuggle i N. Mårtensson, „Core-Level Binding Energies in Metals,” J. Electron Spectrosc. Relat. Phenom., 1980, 21, 275.
.