Ogólne właściwości soli
Niektóre z charakterystycznych właściwości soli to:
- Punkty topnienia i wrzenia: Sole są w większości ciałami stałymi, które topią się, jak również gotują w wysokich temperaturach.
- Rozpuszczalność w wodzie: Sole są na ogół rozpuszczalne w wodzie. Na przykład, chlorek sodu, siarczan potasu, azotan glinu, węglan amonu, itp. są solami rozpuszczalnymi, podczas gdy chlorek srebra, chlorek ołowiu, węglan miedzi, itp. są nierozpuszczalne w wodzie.
- Woda krystalizacyjna: Ogólnie, sole występują jako kryształy z obecnymi w nich cząsteczkami wody. Woda ta nazywana jest wodą krystalizacyjną, a sole takie nazywane są solami uwodnionymi.
Na przykład kryształ siarczanu miedzi ma pięć cząsteczek wody na każdą cząsteczkę siarczanu miedzi. Jest to zapisane jako CuSO4.5H2O. Ta woda krystalizacyjna nadaje kryształowi jego kształt. Nadaje ona również kolor niektórym kryształom. Podczas ogrzewania uwodnione sole tracą wodę krystalizacyjną, w wyniku czego kryształy tracą swój kształt i barwę i zmieniają się w proszkową substancję.
Uwodnione sole, które utraciły wodę krystalizacyjną nazywamy solami bezwodnymi.
Gdy uwodniony siarczan miedzi jest ogrzewany, wydziela cząsteczki wody tworząc biały proszek bezwodnego siarczanu miedzi. Po dodaniu wody, substancja ta może ponownie przekształcić się w roztwór uwodnionego siarczanu miedzi.
Ludzie pytają również
- Klasyfikacja soli
- Zastosowanie różnych soli w życiu codziennym
- Przygotowanie soli
- Opisać przygotowanie soli rozpuszczalnych i nierozpuszczalnych
- Analiza ilościowa. Analiza soli
- Działanie ciepła na sole
- Testowanie kationów i anionów w roztworach wodnych
- Konstruowanie równań jonowych metodą wariacji ciągłej
- Co to jest stechiometria i dlaczego jest używana w chemii?
Ogólne właściwości soli :
1. Reakcja z kwasem: Kiedy sól reaguje z kwasem, powstaje inna sól i kwas. Na przykład, gdy chlorek sodu jest ogrzewany z kwasem siarkowym, powstaje wodorosiarczan sodu (w niskiej temperaturze), a następnie siarczan sodu (w wysokiej temperaturze) i wydziela się gazowy chlorowodór.
2. Reakcja z zasadą : Sól reaguje z zasadą, tworząc inną sól i zasadę.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reakcja z metalem : Czasami roztwór soli może reagować z metalem. Na przykład, gdy żelazny gwóźdź jest zanurzony w wodnym roztworze siarczanu miedzi, miedź osadza się na powierzchni gwoździa, a powstały siarczan żelazawy pozostaje w roztworze.
CuSO4 + Fe → FeSO4 + Cu
Reakcja ta pokazuje, że żelazo jest bardziej reaktywne niż miedź.
Tak więc, bardziej reaktywny metal może wyprzeć mniej reaktywny metal z roztworu jego soli.
4. Zachowanie się soli wobec wody :
Gdy sól rozpuszcza się w wodzie, roztwór może być obojętny, kwaśny lub zasadowy. Zależy to od rodzaju użytej soli.
(i) Zwykła sól otrzymana z mocnego kwasu i mocnej zasady daje roztwór obojętny. Na przykład, wodne roztwory NaCl i K2SO4 są obojętne dla lakmusu.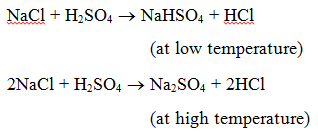
(ii) Zwykła sól otrzymana ze słabego kwasu i silnej zasady daje roztwór alkaliczny. Na przykład wodne roztwory zarówno węglanu sodu (Na2CO3), jak i octanu sodu (CH3COONa) są zasadowe.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Sól pochodząca od mocnego kwasu i słabej zasady daje roztwór kwaśny. Na przykład, zarówno chlorek glinu (AlCl3) jak i chlorek amonu (NH4Cl) tworzą kwaśne roztwory wodne.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Roztwory kwaśnych soli są kwaśne w stosunku do lakmusu, tzn. roztwory te zmieniają kolor niebieski papierka lakmusowego na czerwony. Na przykład, roztwór wodorosiarczanu sodu (NaHSO4) zabarwia papierek lakmusowy na niebiesko.