- Monografia produktu Prilosec OTC
- 1.1 Charakterystyka częstego występowania zgagi
- 1.2 Leki na zgagę dostępne bez recepty
- Opis
- Skład
- 3.1 Substancja czynna
- 3.2 Składniki nieaktywne
- Farmakologia kliniczna
- 4.1 Mechanizm działania
- 4.2 Zahamowanie wydzielania kwasu żołądkowego
- 4.3 Farmakokinetyka
- Badania skuteczności klinicznej
- 5.1 Pierwszorzędowy punkt końcowy skuteczności (brak zgagi przez 24 godziny)
- 5.2 Wyniki drugorzędowych punktów końcowych skuteczności (brak zgagi nocnej i zgaga łagodna)
- OTC Label Comprehension And Compliance
- 6.1 Wyniki badań zgodności
- Wskazania i stosowanie
- Bezpieczeństwo
- 8.1 Przeciwwskazania
- 8.2 Interakcje z lekami
Monografia produktu Prilosec OTC
Tutaj znajdują się wszystkie szczegóły potrzebne do lepszego zrozumienia produktu Prilosec OTC przed zaleceniem go pacjentom.
Prilosec OTC (omeprazol 20 mg w postaci omeprazolu magnezowego 20,6 mg) został zatwierdzony przez amerykańską Agencję ds. Żywności i Leków jako lek dostępny bez recepty (OTC) w leczeniu częstej zgagi, definiowanej jako zgaga występująca dwa lub więcej dni w tygodniu. Dzięki produktowi Prilosec OTC pracownicy służby zdrowia mają do dyspozycji dostępną bez recepty opcję terapeutyczną, którą mogą zalecać dorosłym pacjentom z częstymi objawami zgagi.
W przeszłości opcje postępowania dla konsumentów samodzielnie leczących się obejmowały leki zobojętniające i antagonistów receptora H2 (H2RA). Obecnie konsumenci mają dostęp do IPP, w tym POTC, długotrwałej opcji leczenia w celu kontrolowania częstych objawów zgagi – jedna dawka dziennie działa do 24 godzin w ramach 14-dniowego kursu terapii. Ten rozdział zawiera przegląd informacji na temat częstego występowania zgagi i nawyków związanych z jej leczeniem.
1.1 Charakterystyka częstego występowania zgagi
Zgaga jest opisywana jako uczucie dyskomfortu w środkowej części klatki piersiowej, przechodzące do gardła i szyi, któremu towarzyszy palące lub bolesne uczucie pod mostkiem. Badanie przeprowadzone w 2003 roku wykazało, że w Stanach Zjednoczonych około 65% dorosłej populacji doświadcza zgagi, a zgaga występuje codziennie u około 15 milionów dorosłych.1a
Nieznacznie więcej kobiet (59%) niż mężczyzn zgłasza częstą zgagę.1a,2 Średni wiek konsumenta z częstą zgagą wynosi 45-50 lat,1a a zgaga ma niewielką tendencję do nasilania się wraz z wiekiem.2 Położenie geograficzne, stan cywilny, stan rodzinny (dzieci), poziom wykształcenia, rodzaj i poziom wykonywanej pracy oraz status socjoekonomiczny mają wpływ na skłonność do występowania zgagi.3
Rycina 1 przedstawia częstość występowania wszystkich epizodów zgagi w badaniu przeprowadzonym w 2003 roku wśród reprezentatywnej populacji dorosłych cierpiących na zgagę.1a
Rycina 1. Częstość występowania zgagi w amerykańskiej populacji osób cierpiących na zgagę1a

Konsumenci z częstą zgagą zgłaszali długą historię występowania objawów zgagi.
Większość konsumentów z częstą zgagą rozmawiała o swoich objawach z pracownikami służby zdrowia. Większość konsumentów z częstą zgagą (62%) zgłosiła swoje objawy lekarzowi pierwszego kontaktu, odpowiednio 16% i 2% było u gastroenterologa lub kardiologa, a 30% konsultowało się z farmaceutami.1a
1.2 Leki na zgagę dostępne bez recepty
Większość konsumentów z częstą zgagą samodzielnie diagnozuje i leczy się za pomocą dostępnych leków bez recepty. W badaniu przeprowadzonym w 2001 roku około 80% osób z częstą zgagą zgłosiło stosowanie leków na zgagę dostępnych bez recepty.1a
W tym badaniu ponad 70% osób często cierpiących na zgagę uznało swoje objawy za umiarkowane lub ciężkie, a większość osób cierpiących na zgagę zgłosiła stosowanie leków przy pierwszych oznakach objawów, aby zapobiec ich nasileniu lub je złagodzić. Ogólnie rzecz biorąc, konsumenci z częstą zgagą zgłaszali radzenie sobie ze zgagą poprzez stosowanie samych leków zobojętniających lub w połączeniu z H2RA dostępnymi bez recepty lub IPP wydawanymi na receptę.1a
Opis
Prilosec OTC jest dostarczany w opakowaniach po 14 tabletek, 28 tabletek i 42 tabletki. Rozmiary te zawierają odpowiednio jeden, dwa i trzy 14-dniowe kursy leczenia. Prilosec OTC to tabletki w kolorze różowym (łososiowym) składające się z wielu granulek powlekanych dojelitowo, zawierających 20,6 mg omeprazolu magnezowego, co odpowiada 20 mg omeprazolu. Substancją czynną jest sól magnezowa omeprazolu, która umożliwia tabletkowanie. Prilosec OTC jest również dostępny w tabletce o smaku Wildberry, która zapewnia intensywny smak podczas połykania tabletki. Prilosec OTC Wildberry nie jest przeznaczony do żucia ani ssania. Jest to tabletka o purpurowym kolorze, dostępna w rozmiarach 14 i 42 ct. Obecnie ten preparat w postaci tabletek jest sprzedawany jako produkt OTC w Szwecji i jako produkt na receptę w ponad 30 innych krajach.1a
Skład
3.1 Substancja czynna
Składnikiem czynnym w tabletkach o opóźnionym uwalnianiu Prilosec OTC jest omeprazol magnezowy; jego nazwa chemiczna to di-5-metoksy-2-sulfinylo]-1H-benzimidazol magnezowy. Masa cząsteczkowa omeprazolu magnezowego wynosi 713,1. Jego wzór strukturalny przedstawiono na rysunku 2.4
Magnez omeprazolu jest substancją krystaliczną, która jest łatwo rozpuszczalna w metanolu i słabo rozpuszczalna w wodzie. Omeprazol magnezowy szybko dysocjuje w wodzie, tworząc omeprazol i magnez.4
Rysunek 2. Struktura chemiczna omeprazolu magnezowego4

3.2 Składniki nieaktywne
Składniki nieaktywne lekurilosec OTC: Monostearynian glicerolu, hydroksypropyloceluloza, hypromeloza, tlenek żelaza, stearynian magnezu, kopolimer kwasu metakrylowego, celuloza mikrokrystaliczna, parafina, glikol polietylenowy 6000, polisorbat 80, poliwinylopirolidon, stearylowy fumaran sodu, skrobia, sacharoza, talk, dwutlenek tytanu, cytrynian trietylu5
Prilosec OTC Wildberry Flavor Składniki nieaktywne: FD&C blue no. 2 aluminium lake, FD&C red no. 40 aluminium lake, aromat, monostearynian glicerolu, hydroksypropyloceluloza, hypromeloza, stearynian magnezu, kopolimer kwasu metakrylowego, mika, celuloza mikrokrystaliczna, glikol polietylenowy 6000, polisorbat 80, poliwinylopirolidon, sacharyna sodowa, stearylowy fumaran sodu, skrobia, sacharoza, talk, dwutlenek tytanu, cytrynian trietylu
Farmakologia kliniczna
4.1 Mechanizm działania
Omeprazol należy do klasy leków znanych jako podstawione benzimidazole.6 Omeprazol wiąże się nieodwracalnie z pompą protonową (układ enzymatyczny H+/K+-ATPazy) na powierzchni wydzielniczej komórki okładzinowej żołądka.6-8 Wiązanie to hamuje lub tłumi zdolność komórki okładzinowej do wydzielania kwasu żołądkowego (rysunek 3).
Rysunek 3. Mechanizm działania omeprazolu4

Farmakologia kliniczna
4.2 Zahamowanie wydzielania kwasu żołądkowego
Refluks kwasu żołądkowego do przełyku jest główną przyczyną objawów zgagi. Omeprazol hamuje zarówno podstawowe, jak i stymulowane wydzielanie kwasu z komórki ciemieniowej, niezależnie od bodźca. W ciągu 24 godzin wydzielanie kwasu przez komórki ciemieniowe żołądka wynosi około 50% maksimum po podaniu pojedynczej dawki. Po odstawieniu omeprazolu zdolność do wydzielania kwasu żołądkowego powraca stopniowo w ciągu kilku dni, ponieważ wytwarzane są nowe pompy protonowe.4
Dane farmakodynamiczne wykazały, że omeprazol w dawce 20 mg na dobę zapewnia wyraźne i stałe hamowanie wydzielania kwasu żołądkowego w ciągu 24 godzin.4 Wielkość i spójność tego działania były znacznie lepsze w przypadku omeprazolu w dawce 20 mg w porównaniu z omeprazolem w dawce 10 mg na dobę. Rycina 4 ilustruje lepsze i bardziej spójne działanie antysekrecyjne omeprazolu podawanego w dawkach 20 mg lub większych.9 Pokazuje również, że dobowa dawka omeprazolu 20 mg powoduje znacznie silniejsze i bardziej spójne hamowanie niż niższe dawki, ale nie całkowitą blokadę wydzielania kwasu żołądkowego w 24-godzinnym przedziale dawkowania.
Rycina 4. Hamujący wpływ jednego tygodnia leczenia dobowymi dawkami omeprazolu na 24-godzinne wewnątrzżołądkowe wydzielanie kwasu9

4.3 Farmakokinetyka
Dostępność biologiczna
Badanie z udziałem 29 zdrowych osób z USA. Wykazano, że biodostępność tabletek Prilosec OTC jest podobna do biodostępności dostępnych w handlu kapsułek Prilosec® (omeprazol) 20 mg wydawanych na receptę (patrz rysunek 5).4 Uczestnikom podawano produkt leczniczy jako pojedynczą dawkę poranną na czczo. Badanie było randomizowanym, otwartym, krzyżowym badaniem z pięciodniowym okresem przerwy pomiędzy kolejnymi kuracjami. Preparat w postaci tabletek jest sprzedawany w Szwecji jako produkt OTC i w ponad 30 innych krajach jako produkt na receptę.1a
Ryc. 5. Średnie stężenie omeprazolu w osoczu w funkcji czasu: osoby z możliwymi do oceny danymi farmakokinetycznymi (n = 29)4

Wchłanianie, dystrybucja i metabolizm
Ponieważ peletki zawierające omeprazol magnezowy w tabletkach Prilosec OTC są powlekane enterycznie, nie należy dzielić tabletek, ponieważ mogłoby to spowodować naruszenie powłoki. Ze względu na powłokę jelitową, wchłanianie rozpoczyna się dopiero po przedostaniu się peletek do dwunastnicy. Jest to ważne, ponieważ narażenie na kwaśne środowisko żołądka przed wprowadzeniem do krążenia ogólnoustrojowego spowodowałoby degradację cząsteczki omeprazolu, co mogłoby ograniczyć jego ostateczną skuteczność. Gdy magnez omeprazolu rozpuści się w tym prawie neutralnym środowisku dwunastnicy, jon omeprazolu przekształca się w postać obojętną. Ta sama postać omeprazolu jest dostępna do wchłaniania bez względu na to, czy jest on podawany w postaci wolnej, omeprazolu, czy soli, omeprazolu magnezowego.10 Wchłanianie jest szybkie, a szczytowe stężenie omeprazolu w osoczu (Cmax) występuje w ciągu 0,5 do 3,5 godziny po podaniu doustnym.4 U zdrowych dorosłych osób okres półtrwania w osoczu (t1/2) wynosi 0,5 do 1,0 godziny, a całkowity klirens ustrojowy wynosi 500 do 600 ml/min. Czas działania omeprazolu wynosi więcej niż 24 godziny po podaniu pojedynczej dawki, ponieważ komórki ciemieniowe ulegają przemianie w ciągu około trzech do pięciu dni. Wiązanie z białkami wynosi około 95%. Hamowanie wydzielania kwasu jest związane z polem powierzchni pod krzywą stężenia w osoczu w czasie, ale nie z rzeczywistym stężeniem w osoczu w danym czasie.
Omeprazol jest całkowicie metabolizowany w wątrobie przez izoenzymy cytochromu P450. Powstaje co najmniej sześć metabolitów, które mają niewielkie lub żadne działanie antysekrecyjne. Metabolity omeprazolu są usuwane głównie z moczem i wtórnie z kałem.4
Badania skuteczności klinicznej
Dwa dobrze kontrolowane badania kliniczne z udziałem 3120 osób popierają stosowanie kolejnych 14-dniowych schematów terapeutycznych omeprazolu magnezowego w leczeniu częstej zgagi. Oba badania były wieloośrodkowe, prowadzone metodą podwójnie ślepej próby, randomizowane, równoległe i kontrolowane placebo. W każdym badaniu oceniano dawki 10 mg i 20 mg omeprazolu magnezowego przez 14 kolejnych dni u osób ze zgagą występującą dwa lub więcej dni w tygodniu.1a
Badania miały tygodniową fazę wstępną z placebo w celu oceny częstości zgagi. Kwalifikujący się uczestnicy byli randomizowani do dwutygodniowej fazy leczenia z zastosowaniem podwójnie ślepej próby w celu otrzymania pojedynczej dawki dziennej omeprazolu magnezowego 10 mg, omeprazolu magnezowego 20 mg lub placebo każdego dnia. Uczestnicy przyjmowali dzienną dawkę badanego leku codziennie rano przed śniadaniem.1a
Pierwszorzędowym punktem końcowym skuteczności był „brak zgagi w ciągu poprzednich 24 godzin” (tj. całkowity brak zgagi przez cały dzień). Skuteczność oceniano po podaniu pierwszej dawki leku, po podaniu ostatniej dawki oraz w ciągu 14 dni dawkowania w fazie podwójnie ślepej próby.1a
Po podaniu pierwszej dawki leku i kolejnych dawek badano również szereg drugorzędowych punktów końcowych skuteczności. Należały do nich „całkowite zapobieganie nocnej zgadze” oraz „występowanie zgagi nie większej niż łagodna „1b
5.1 Pierwszorzędowy punkt końcowy skuteczności (brak zgagi przez 24 godziny)
W obu badaniach klinicznych wykazano, że podawanie 20 mg omeprazolu magnezowego powodowało znaczący efekt leczenia w ciągu pierwszej doby. Jak przedstawiono na rycinie 6, prawie 50% uczestników w grupach leczonych omeprazolem magnezowym w dawce 20 mg nie odczuwało zgagi przez cały dzień po przyjęciu pierwszej dawki w porównaniu z około 32% uczestników w grupie placebo (rycina 6).1a
Rycina 6. Odsetek osób, u których zgaga nie występowała przez 24 godziny – Dzień 11a
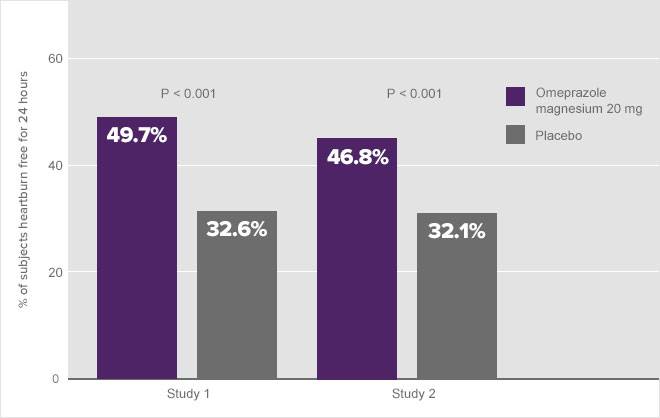
W Dniu 14, odsetek osób zgłaszających całkowite ustąpienie zgagi wynosił ponad 70% (Rycina 7).1a
Wykres 7. Odsetek badanych, u których zgaga nie występowała przez 24 godziny w ciągu 14 dni1a

5.2 Wyniki drugorzędowych punktów końcowych skuteczności (brak zgagi nocnej i zgaga łagodna)
Ogółem, wyniki dla tych punktów końcowych potwierdziły wyniki dla pierwszorzędowych punktów końcowych.1a
Gdy do punktu końcowego skuteczności dodano osoby z jedynie łagodną zgagą, ponad 80% osób otrzymujących omeprazol z magnezem zgłosiło znaczącą korzyść terapeutyczną w dniu 1 (ryc. 8).1a
Ryc. 8. Odsetek osób z nie więcej niż łagodną zgagą – dzień 11a

OTC Label Comprehension And Compliance
6.1 Wyniki badań zgodności
Zachowanie konsumentów i zrozumienie stosowania produktu Prilosec OTC oceniano w badaniach dotyczących zrozumienia etykiety oraz w badaniu dotyczącym rzeczywistego stosowania produktu. Ten program badań ustalił zgodność z instrukcjami na etykiecie i stosowanie produktu w warunkach bez nadzoru. Dokładniej, program został opracowany w celu ustalenia, czy konsumenci rozumieją: 1) populację, dla której Prilosec OTC jest najbardziej odpowiedni (samodzielny wybór na podstawie częstości występowania zgagi i zrozumienia ostrzeżeń na etykiecie); 2) kiedy i jak należy przyjmować Prilosec OTC (jedna tabletka dziennie przez 14 kolejnych dni); oraz 3) kiedy należy skontaktować się z pracownikiem służby zdrowia (w odpowiedzi na określone ostrzeżenia lub w przypadku nawrotu częstej zgagi). W badaniu dotyczącym rzeczywistego stosowania określono przestrzeganie zaleceń podanych na etykiecie w warunkach rzeczywistego stosowania.1a
-
W przypadku każdego z kryteriów samodzielnego wyboru, właściwy wybór był większy niż 90% w całej populacji.
1a
-
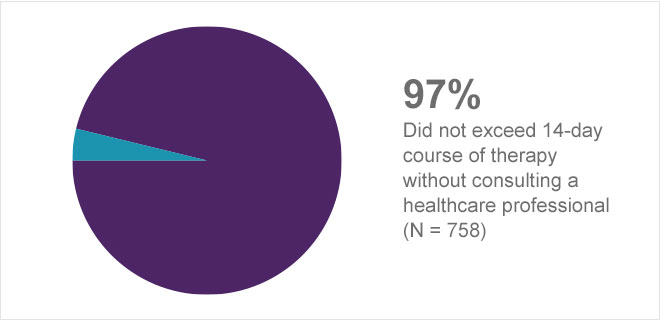
Badani, którzy zdecydowali się na stosowanie produktu, w dużym stopniu przestrzegali zaleceń dotyczących dawkowania podanych na etykiecie, przy czym ponad 91% badanych stosowało produkt zgodnie z zaleceniami podanymi na etykiecie, przyjmując nie więcej niż jedną tabletkę na dawkę i nie więcej niż jedną tabletkę na dobę.
1a
-
Podczas trzymiesięcznego wywiadu kontrolnego konsumenci, u których wystąpił nawrót objawów zgagi, nadal wykazywali zachowania zgodne z zaleceniami podanymi na etykiecie.
1a
Wyniki tych badań zdecydowanie potwierdzają właściwe stosowanie produktu Prilosec OTC przez konsumentów z częstą zgagą i potwierdzają zdolność konsumentów do prawidłowego stosowania produktu zgodnie z proponowanymi wskazówkami na etykiecie OTC (rysunek 9).1a
Rysunek 9. Zgodność dawkowania1a
Wskazania i stosowanie
Prilosec OTC 20 mg tabletki są wskazane w leczeniu częstej zgagi, która jest zdefiniowana jako zgaga występująca dwa lub więcej dni w tygodniu. Na etykiecie produktu Prilosec OTC podano następujące wskazówki dotyczące właściwego stosowania przez konsumentów z częstą zgagą5:

-
Jedna tabletka na dobę leczy częstą zgagę przez 24 godziny w ramach 14-dniowej terapii.
-
Dawka QD minimalizuje niedogodności i zachęca do przestrzegania zaleceń.
-
Stosować 14-dniowy schemat dawkowania w leczeniu częstej zgagi.
-
Wskazówki na etykiecie zachęcają konsumentów do skonsultowania się z lekarzem.
-
Konsumentom zaleca się stosowanie nie więcej niż jednego 14-dniowego kursu leczenia co cztery miesiące, chyba że lekarz zaleci inaczej.
Bezpieczeństwo
8.1 Przeciwwskazania
Prilosec OTC jest przeciwwskazany u osób, u których występuje nadwrażliwość na omeprazol. Konsumenci, u których występują pewne stany chorobowe i (lub) objawy, powinni zgodnie z zaleceniami na etykiecie nie stosować produktu lub skonsultować się z lekarzem.5
8.2 Interakcje z lekami
Potencjalne interakcje metaboliczne omeprazolu (metabolizowanego głównie przez wątrobowy izoenzym cytochromu P450 CYP2C19) były systematycznie badane, szczególnie w odniesieniu do warfaryny, diazepamu, digoksyny i klopidogrelu.4
Wydane przez FDA Health Advisory
Dowiedz się, dlaczego dane zalecają unikanie połączenia produktu Prilosec OTC (omeprazol) i produktu Plavix® (klopidogrel).
Choć istotne klinicznie interakcje pomiędzy warfaryną lub digoksyną a omeprazolem są mało prawdopodobne, węższe okno terapeutyczne dla tych leków doprowadziło do zachowania ostrożności poprzez umieszczenie ich na etykiecie produktu Prilosec OTC.4
W dodatku, FDA wymagała oznakowania ostrzegającego pacjentów, aby nie używali POTC, jeśli przyjmują:
cilostizol, leki przeciwgrzybicze lub przeciwdrożdżakowe na receptę, diazepam, digoksynę, takroimus, mykofenolan mofetylu, leki przeciwretrowirusowe na receptę i metotreksat.
Warfaryna
Dostarczone po wprowadzeniu do obrotu doniesienia o zmianach wartości wskaźników protrombiny dotyczyły pacjentów leczonych jednocześnie warfaryną i omeprazolem. Zwiększenie INR i czasu protrombinowego może prowadzić do nieprawidłowego krwawienia, a nawet zgonu. Pacjenci leczeni jednocześnie IPP i warfaryną mogą wymagać monitorowania pod kątem zwiększenia INR i czasu protrombinowego.
Diazepam
Podawanie z diazepamem zostało również wymienione w punkcie Ostrzeżenia, ponieważ omeprazol znacząco zmniejsza klirens diazepamu, chociaż stosunkowo szerokie okno terapeutyczne dla diazepamu sprawia, że jest mało prawdopodobne, aby to działanie omeprazolu było istotne klinicznie.4
Leki przeciwretrowirusowe
Zgłaszano, że jednoczesne podawanie omeprazolu może wpływać na stężenie w osoczu leków przeciwretrowirusowych, dlatego zaleca się odpowiednie monitorowanie kliniczne.
Metotreksat
Dane wydają się wskazywać, że interakcja lek-lek pomiędzy omeprazolem a metotreksatem może być związana ze zmniejszoną eliminacją metotreksatu, co prowadzi do toksyczności metotreksatu. Zatwierdzone etykiety produktów wydawanych na receptę zawierających metotreksat oraz wszystkie etykiety produktów wydawanych na receptę zawierających IPP zawierają tę informację.
Takrolimus
Współczesne podawanie omeprazolu i takrolimusu może zwiększać stężenie takrolimusu w surowicy.
Leki o wchłanianiu zależnym od pH
Tak jak w przypadku innych IPP i H2RA, omeprazol zwiększa pH wewnątrzżołądkowe (zmniejsza kwasowość), co może wpływać na wchłanianie leków, których wchłanianie zależy od pH, np, ketokonazol, itrakonazol lub mykofenolan mofetylu. W jednym z badań wykazano, że wchłanianie ketokonazolu było znacznie zmniejszone po podaniu omeprazolu. Podobnie w innym badaniu wykazano, że wchłanianie itrakonazolu było zmniejszone, jeśli podawano go po dwutygodniowym schemacie omeprazolu.4
Kolejne podawanie mykofenolanu mofetylu z IPP powoduje zmniejszenie ekspozycji ogólnoustrojowej mykofenolanu mofetylu, na podstawie badań cytowanych w literaturze.11 Działanie to jest prawdopodobnie spowodowane hamowaniem wydzielania kwasu żołądkowego przez IPP, co może prowadzić do niepełnego rozpuszczenia mykofenolanu mofetylu i w konsekwencji do słabego wchłaniania. Informacja ta jest zawarta w aktualnych etykietach mykofenolanu mofetylu wydawanych na receptę.
W związku z tym na etykiecie produktu Prilosec OTC potencjalne interakcje z tymi lekami są wymienione w części Ostrzeżenia w ramce informacyjnej leku.5
Specjalne populacje
Stosowanie w ciąży i laktacji: Etykieta leku Prilosec OTC zaleca kobietom w ciąży lub karmiącym piersią skonsultowanie się z lekarzem przed zastosowaniem leku.5
Stosowanie u dzieci: Prilosec OTC jest wskazany w leczeniu częstej zgagi u osób w wieku 18 lat lub starszych. W przypadku dzieci w wieku poniżej 18 lat z częstą zgagą, etykieta zaleca konsultację z lekarzem przed zastosowaniem.5
Zdarzenia niepożądane
Lekarze przepisali omeprazol milionom pacjentów w celu bezpiecznego leczenia stanów związanych z nadkwaśnością.7
Bezpieczeństwo omeprazolu zostało potwierdzone w 15 nowych badaniach klinicznych OTC z omeprazolem magnezowym (n > 18 000). Najczęstszymi zdarzeniami niepożądanymi były ból głowy i biegunka, zgodne z występującymi w badaniach klinicznych i nadzorze po wprowadzeniu do obrotu produktu Prilosec na receptę. Prilosec OTC miał podobny profil tolerancji jak placebo.1a
Dostępność i przechowywanie
Prilosec OTC tabletki w dawce 20 mg są dostarczane w opakowaniach blistrowych. Prilosec OTC jest dostępny bez recepty w trzech różnych rozmiarach 5:
-
Opakowanie 14 tabletek (jeden 14-dniowy kurs leczenia)
-
Opakowanie 28 tabletek (dwa 14-dniowe kursy leczenia)
-
Opakowanie 42 tabletek (trzy 14-dniowe kursy leczenia)
Prilosec OTC Wildberry Flavor tabletki a dawce 20 mg dostarczane są w opakowaniach typu blister. Prilosec OTC Wildberry Flavor jest dostępny bez recepty w dwóch różnych rozmiarach5:
-
Pakiet 14 tabletek (jeden 14-dniowy kurs leczenia)
-
Pakiet 42 tabletek (trzy 14-dniowe kursy leczenia)
Warunki przechowywania
-
Przechowywać w temperaturze 20°C do 25°C (68°F do 77°F). 5
-
Chronić przed wilgocią. 5
1a Dane w pliku. Procter & Gamble.
1b Porównanie preparatu Prilosec OTC™ (omeprazol magnezowy 20,6 mg) z placebo przez 14 dni w leczeniu częstej zgagi. Journal of Clinical Pharmacy and Therapeutics. 2005;30:105-112.
2 Oliveria SA, Christos PJ, Talley NJ, et al. Heartburn risk factors, knowledge, and prevention strategies: a population-based survey of individuals with heartburn. Arch Intern Med. 1999;159:1592-1598.
3 Profil konsumentów w potrzebie. Kiedy Południe znów wstaje, to prawdopodobnie tylko gaz: lekkie spojrzenie na ciężkie żołądki. Progressive Grocer 1995;98-99.
sup>4 Dane w pliku. AstraZeneca LP.
5 Prilosec OTC . Cincinnati, Ohio: Procter & Gamble; 2015.
6 Massoomi F, Savage J, Destache CJ. Omeprazol: kompleksowy przegląd. Pharmacotherapy 1993;13:46-59.
7 Prilosec . Wilmington, Del: AstraZeneca LP; 2015.
8 Lindberg P, Brändström A, Wallmark B, et al. Omeprazol: pierwszy inhibitor pompy protonowej. Med Res Rev. 1990;10:1-54.
9 Lind T, Cederberg C, Axelson M, et al. Long-term acid inhibitory effect of different daily doses of omeprazole 24 hours after dosing. Scand J Gastroenterol. 1986;21(suppl 118):137-138.
10 Losec . Auckland, Nowa Zelandia: AstraZeneca Limited; 2015.
11The role of proton pump inhibitors on early mycophenolic acid exposure in kidney transplantation: evidence from the CLEAR study. Kiberd BA, Wróbel M, Danavino R, et al. Ther Drug Monit. 2011 Feb; 33(1):120-3; Proton pump inhibitors reduce mycophenolate exposure in heart transplant recipients – a prospective case controlled study. Kofler S, Shvets N, Bigdeli AK, et al. Amer J. Transplant. 2009 Jul; 9(7):1650-6. Epub 2009 June 10.
.