Wprowadzenie
Mózg ludzki przechodzi rozległe dojrzewanie przez całe życie, aby ułatwić rozwój poznawczy. Mielinizacja aksonów w całym układzie nerwowym jest jednym z takich kluczowych procesów dojrzewania. W ośrodkowym układzie nerwowym (OUN), komórki glejowe zwane oligodendrocytami rozszerzają wiele procesów do ich otoczenia, które koncentrycznie owijają błonę wokół aksonów, tworząc osłonki mielinowe. Osłonki mielinowe umożliwiają szybkie, saltacyjne przewodzenie potencjałów czynnościowych poprzez lokalizację kanałów Na+ zależnych od napięcia w krótkich szczelinach pomiędzy sąsiednimi osłonkami (zwanych węzłami Ranviera) oraz poprzez działanie jako izolatory elektryczne. Aksony, które są w pełni mielinizowane na całej swojej długości przewodzą impulsy wielokrotnie szybciej niż aksony nie mielinizowane o tym samym przekroju poprzecznym (Waxman, 1980). Dlatego też, mielinizowane obwody neuronalne przewodzą informacje znacznie szybciej niż obwody nie mielinizowane. Ludzie rodzą się z praktycznie niezmielinizowanym OUN, a populacja oligodendrocytów gwałtownie się powiększa po urodzeniu, z powszechną mielinizacją w pierwszych latach dzieciństwa. Mielinizacja jest kontynuowana w okresie dojrzewania i w wieku dorosłym w charakterystyczny sposób przestrzenno-czasowy, korelując z pojawieniem się i utrzymaniem prawidłowej funkcji obwodów. Na przykład, dojrzewanie istoty białej (obszarów OUN bogatych w mielinę) jest zbieżne z rozwojem dziecięcych procesów poznawczych, takich jak szybkość przetwarzania informacji (Mabbott i in., 2006; Scantlebury i in., 2014). Dodatkowo, patologię/nieprawidłowości mieliny obserwuje się nie tylko w chorobie demielinizacyjnej, jaką jest stwardnienie rozsiane, ale także w kilku chorobach neurodegeneracyjnych (Kang i in., 2013; Huang i in., 2015) i zaburzeniach neurorozwojowych (Takahashi i in., 2011). Mielinizacja poszczególnych aksonów nie jest jednak zjawiskiem typu „wszystko albo nic”. Aksony w OUN wykazują duże zróżnicowanie pod względem liczby osłonek mielinowych, długości osłonek, grubości osłonek i ich rozmieszczenia na całej długości. Istnieje wiele różnych wzorów mielinizacji; na przykład aksony ze słabo mielinizowanymi regionami zostały opisane w młodocianej i dorosłej korze myszy (Tomassy i in., 2014; Hill i in., 2018; Hughes i in., 2018). Modyfikacja któregokolwiek z tych parametrów osłonki ma przewidywalny wpływ na szybkość przewodzenia leżącego u jej podłoża aksonu – dlatego ustalenie określonego wzoru mielinizacji wzdłuż aksonu może być szczególnie ważne dla precyzyjnego dostrojenia funkcji obwodu. Na przykład, aksony w słuchowym pniu mózgu gerbili wykazują stopniowo krótsze osłonki mielinowe wzdłuż dystalnych regionów, aby zapewnić precyzyjny czas dotarcia sygnału w celu ułatwienia lokalizacji dźwięku (Ford i in., 2015). Subtelne zmiany w ogólnym wzorze mielinizacji wzdłuż aksonu (albo poprzez dodanie nowej mieliny, albo przebudowę istniejącej mieliny) mogą dogłębnie zmienić czas dotarcia impulsów nerwowych w obwodach. Jeśli mielina jest adaptowalny następnie modyfikując takie wzory mielinizacji może stanowić potężny mechanizm w regulacji funkcji obwodu przez całe życie.
Ostatnie dowody sugerują, że mielina może być adaptowalny w odpowiedzi na aktywność obwodu. Obrazowanie tensora dyfuzji w całym mózgu może być wykorzystane do pomiaru szerokich zmian w bogatej w mielinę istocie białej w czasie – takie eksperymenty u ludzi i gryzoni wykazały, że uczenie się nowego zadania koreluje ze zmianami istoty białej w odpowiednich regionach mózgu (Scholz i in., 2009; Sampaio-Baptista i in., 2013). Analizy na poziomie komórkowym w modelach zwierzęcych wykazują, że produkcja nowych mielinizujących oligodendrocytów jest wymagana do efektywnego uczenia się motorycznego (McKenzie i in., 2014; Xiao i in., 2016). Obecnie stawia się hipotezę, że aktywność obwodów neuronalnych może wywoływać zmiany w mielinie; obszerny materiał badawczy wykazał, że aktywność neuronów może wpływać na proliferację komórek prekursorowych oligodendrocytów (OPCs), różnicowanie oligodendrocytów oraz tworzenie i wzrost osłonek mielinowych. Badania te, w tym dowody na zaangażowane sygnały molekularne, zostały obszernie omówione w innych miejscach (Fields, 2015; Almeida i Lyons, 2017; Mount i Monje, 2017). Aktywność neuronów mogłaby napędzać zmiany w mielinie, które z kolei mogłyby zmienić prędkości przewodzenia, aby dostroić timingi leżące u podstaw funkcji obwodu.
Jednakże nadal nie wiemy, czy lub jak mielinizacja obwodów jest dynamicznie regulowana przez całe życie. Praca gryzoni wskazuje, że nowe oligodendrocyty są generowane w całym OUN nawet w wieku dorosłym (Young et al., 2013), a OPCs rzeczywiście rezydują w ludzkim dorosłym mózgu (Chang et al., 2000). Analiza datowania węglem ludzkich tkanek zidentyfikowała oligodendrocyty urodzone w dorosłym wieku w obrębie kory mózgowej, chociaż te same analizy wskazały, że większość oligodendrocytów w ciele modzelowatym pochodzi z wczesnego dzieciństwa (Yeung i in., 2014). Jednak badania neuroobrazowe u ludzi, które korelują zmiany strukturalne istoty białej z uczeniem się zadań, sugerują, że nowa mielina może powstawać przez całe życie. Taka przedłużona mielinizacja w zasadzie wymagałaby produkcji oligodendrocytów przez całe życie, biorąc pod uwagę, że poszczególne mielinizujące oligodendrocyty mają ograniczone okno czasowe, wynoszące zaledwie kilka godzin, aby zainicjować tworzenie nowych osłonek (Watkins i in., 2008; Czopka i in., 2013), a liczba osłonek na oligodendrocyt wydaje się stabilna w czasie (Tripathi i in., 2017). Jednym zastrzeżeniem zauważonym przez Mount i Monje (2017) jest to, że data „narodzin” w eksperymencie datowania węglem (który identyfikuje punkt czasowy replikacji DNA podczas podziału komórki), odzwierciedla datę OPC, niekoniecznie zróżnicowanego oligodendrocytu. Jest to ważne, biorąc pod uwagę dowody, że OPC mogą bezpośrednio różnicować się w oligodendrocyty bez podziału komórkowego, przynajmniej u gryzoni (Hughes i in., 2013). OPCs w ciele modzelowatym mogły bezpośrednio różnicować się w oligodendrocyty wiele lat po ich terminalnym podziale komórkowym; zatem czas różnicowania się tych nowych oligodendrocytów nie może być określony przez datowanie węglem, a zatem Yeung i wsp. (2014) mogli niedoszacować tempa produkcji oligodendrocytów w dorosłym ludzkim mózgu. Nadal musimy się wiele nauczyć na temat względnego wkładu generacji oligodendrocytów i remodelowania mieliny do rozwoju OUN przez całe życie.
Aby w pełni zrozumieć dokładną dynamikę oligodendrogenezy, tworzenia mieliny i remodelowania mieliny na różnych etapach życia, podłużne obrazowanie w wysokiej rozdzielczości stanowi podejście o złotym standardzie. Poniżej przedstawiamy przegląd ostatnich badań obrazowania in vivo, które zaczynają wyjaśniać dynamikę mielinizacji, co pozwoli nam również zacząć rozumieć, w jaki sposób taka dynamika może wpływać na funkcję obwodu neuronalnego.
De novo Myelination
Aby zacząć definitywnie zajmować się tym, w jaki sposób generowane są oligodendrocyty i w jaki sposób mielina jest wytwarzana i dynamicznie remodelowana in vivo, dwa ostatnie badania wykorzystały powtarzane obrazowanie dwufotonowe kory somatosensorycznej myszy w dłuższych okresach czasu. Hughes i wsp. (2018) obrazowali korę transgenicznych myszy reporterowych z fluorescencyjnie znakowanymi komórkami linii oligodendroglejowej od wczesnej dorosłości, poprzez wiek średni i podeszły (około P720). Odkryli oni, że populacja oligodendrocytów nadal się powiększa, a gęstość korowych oligodendrocytów prawie podwaja się między młodym dorosłym a etapami w średnim wieku (Figura 1A). Towarzyszyło temu ponad dwukrotne zwiększenie liczby korowych osłonek mielinowych. Ale jak dochodzi do wzrostu liczby oligodendrocytów? We wczesnym rozwoju postnatalnym produkowanych jest wiele oligodendrocytów, ale tylko podzbiór przeżywa i przechodzi do mielinizacji aksonów (Barres i in., 1992). Wydaje się, że jest to podobne w dorosłym życiu – śledząc pojedyncze korowe OPC w dorosłej korze przez okres do 50 dni, Hughes i wsp. (2018) ujawnili, że większość nowo zróżnicowanych oligodendrocytów ulega śmierci komórkowej, a tylko 22% przeżywa i angażuje się w mielinizację (Figura 1B). Nadal nie wiadomo, jaka część nowo zróżnicowanych oligodendrocytów jest generowana po podziale OPC w porównaniu z bezpośrednim różnicowaniem. Jednakże, gdy oligodendrocyty zaangażują się w mielinizację, pozostają stabilne, bez dowodów na mielinizujące oligodendrocyty przechodzące śmierć komórkową podczas 50-dniowego okresu obrazowania.
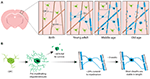
RYSUNEK 1. Dynamika oligodendrocytów i mieliny w korze mózgowej ssaków w ciągu całego życia. (A) Komórki prekursorowe oligodendrocytów (OPCs) stale generują nowe mielinizujące oligodendrocyty (OLs) w korze somatosensorycznej od urodzenia do wieku średniego. Następnie populacja OL zmniejsza się w starszym wieku, czemu towarzyszy redukcja pokrycia mieliną. (B) Lineage-tracing pojedynczych OPCs pokazuje, że chociaż przedmielinowe OLs są stale produkowane w wieku dorosłym, tylko około 20% z nich przeżywa do mielinizacji. Większość osłonek mielinowych, po uformowaniu, zachowuje stabilną długość przez dłuższy czas, co wskazuje, że remodelowanie istniejącej mieliny jest zwykle bardzo niewielkie. Podsumowanie danych z Hill i wsp. (2018) oraz Hughes i wsp. (2018).
Podobnie, Hill i wsp. (2018) użyli transgenicznych reporterów oligodendrocytów i techniki bezetykietowej spektralnej konfokalnej reflektancji (SCoRe) mikroskopii do obrazowania mieliny wzdłuż aksonów (Schain i wsp., 2014) w korze somatosensorycznej młodocianych, młodych dorosłych, w średnim wieku i w starszym wieku myszy (P950). Stwierdzili również, że liczba oligodendrocytów kontynuuje ekspansję w dorosłości do P650, oraz że oligodendrocyty są stabilne w średnim wieku do 80 dni obrazowania. Stwierdzili, że mielinizacja kory również osiąga szczyt w średnim wieku w P650, a gęstość oligodendrocytów znacznie spada od szczytu (w P650) do bardzo starego wieku (P950) (Figura 1A). Znalazło to odzwierciedlenie w zmniejszeniu pokrycia mieliną aksonów korowych warstwy I między P650 a P950. Długotrwałe przeżycie oligodendrocytów może się różnić w różnych częściach OUN. Tripathi i wsp. (2017) znakowali mielinizujące oligodendrocyty w P60 u myszy, a następnie liczyli, ile znakowanych komórek przeżyło do P605 w kilku regionach OUN. Stwierdzili, że w rdzeniu kręgowym i korze ruchowej przeżyło 60-70% komórek znakowanych P60, natomiast w ciele modzelowatym przeżyło ponad 90% komórek znakowanych P60. Zmniejszenie liczby oligodendrocytów i mielinizacji w niektórych regionach OUN wraz z wiekiem rodzi intrygujące pytania dotyczące roli utraty mieliny w związanym z wiekiem pogorszeniu funkcji poznawczych. Analiza MRI pokazuje, że mikrostruktura istoty białej koreluje z inteligencją płynną (Ritchie i in., 2015), ale także, że ta mikrostruktura istoty białej pogarsza się wraz z wiekiem (Cox i in., 2016). Późniejsza związana z wiekiem utrata mieliny może prowadzić do obniżenia funkcji poznawczych z powodu dysregulacji obwodów mielinizowanych.
Czy generacja nowych oligodendrocytów (a następnie nowej mieliny) w dorosłej korze mózgowej może odpowiadać na aktywność obwodów? Poprzednie badania wykazały, że zmniejszenie wejścia sensorycznego poprzez usunięcie trzepaczek u myszy prowadzi do zmniejszonej oligodendrogenezy w korze somatosensorycznej (Hill i in., 2014). Aby zbadać to dalej, Hughes i wsp. (2018) zapewnili dorosłym (P365) myszom stymulację sensoryczną przez 3 tygodnie, zawieszając koraliki w klatkach dla zwierząt, aby wielokrotnie stymulować ich wąsiska, a tym samym korę somatosensoryczną. Poprzez obrazowanie kory somatosensorycznej przed i po 3 tygodniach wykazali, że stymulacja sensoryczna zwiększa liczbę oligodendrocytów, potencjalnie ze względu na zwiększoną przeżywalność nowo zróżnicowanych komórek. Kougioumtzidou i wsp. (2017) dostarczyli kolejnych dowodów na to, że aktywność obwodów może być istotna w regulacji przeżywalności komórek – wykazali, że utrata podjednostek receptora AMPA 2, 3 i 4 w OPCs prowadzi do zmniejszonej przeżywalności oligodendrocytów. To sugeruje, że mielinizacja de novo może być modulowana przez aktywność obwodów korowych przez całe życie, być może w celu dostrojenia funkcji tych samych obwodów.
Wiele pytań pozostaje do rozwiązania: jaki jest wpływ oligodendrogenezy i nowej mielinizacji na rzeczywistą funkcję obwodu? Czy aktywność neuronów zwiększa długoterminowe przeżycie mielinizujących oligodendrocytów? Jest możliwe, że utrata oligodendrocytów w starszym wieku jest spowodowana związaną z wiekiem redukcją aktywności neuronalnej, co z kolei może wpływać na ogólną przeżywalność oligodendrocytów. Alternatywnie, może być tak, że oligodendrocyty mają ograniczoną żywotność niezależnie od aktywności neuronów (albo zaprogramowane wewnętrznie, albo pod wpływem innych zewnętrznych sygnałów związanych ze starzeniem się). W obu przypadkach, stymulacja obwodu mogłaby pomóc złagodzić związaną z wiekiem utratę mieliny poprzez promowanie przeżycia istniejących oligodendrocytów lub stymulowanie produkcji nowych oligodendrocytów. To z kolei może mieć istotne implikacje w leczeniu i zapobieganiu związanej z wiekiem utraty zdolności poznawczych.
Activity-mediated oligodendrogenesis nie jest ograniczona do kory somatosensorycznej – młode dorosłe myszy poddawane uczeniu motorycznemu również wykazują wzrost liczby nowo zróżnicowanych oligodendrocytów w korze ruchowej (Xiao i in., 2016). A co z innymi obszarami OUN? Wiele aksonów korowych rzutuje się przez ciało modzelowate, a zatem stymulacja obwodów korowych może sygnalizować zarówno korowe, jak i modzelowate OPCs. W dwóch badaniach przeprowadzonych na gryzoniach wykazano, że stymulacja neuronów korowych indukuje oligodendrogenezę w obrębie ciała modzelowatego. Gibson i wsp. (2014) stymulowali optogenetycznie neurony projekcyjne warstwy V w korze przedruchowej, stwierdzając wzrost proliferacji OPC zarówno w korze przedruchowej, jak i w ciele modzelowatym. Doprowadziło to do wzrostu liczby oligodendrocytów i grubości osłonki 4 tygodnie po stymulacji. Niedawno Mitew i wsp. (2018) wykorzystali Designer Receptors Exclusively Activated by Designer Drugs do stymulacji neuronów somatosensorycznych warstwy 2/3 i również zaobserwowali zwiększoną proliferację OPC, oligodendrogenezę i grubsze osłonki mielinowe w ciele modzelowatym zarówno u młodych, jak i dorosłych myszy. Wykazali oni również, że nowe oligodendrocyty preferencyjnie tworzą osłonki mielinowe na aktywnych aksonach. Wskazuje to, że indukowana aktywnością mielinizacja de novo może, w zasadzie, być ukierunkowana na aktywne aksony/obwody. Nadal nie wiadomo, jak długotrwałe mogą być zmiany w mielinie w odpowiedzi na aktywność neuronów. Długotrwałe przeżycie komórek mielinizujących odnotowane przez Tripathi i wsp. (2017), Hill i wsp. (2018) oraz Hughes i wsp. (2018) sugeruje, że gdy oligodendrocyt utworzy osłonki mielinowe, prawdopodobnie przetrwa nawet wtedy, gdy poziom aktywności neuronów powróci do poziomu wyjściowego. To, czy same osłonki mielinowe zmieniają się po powrocie aktywności neuronów do normalnego poziomu, wymaga dokładniejszego zbadania dynamiki poszczególnych osłonek, co omówiono poniżej.
Tak więc, możliwe jest, że dożywotnia mielinizacja de novo może wystąpić w wielu regionach OUN, gdzie aksony odpowiednie do mielinizacji mają wystarczającą przestrzeń bez mielinizacji. Jednak pozostaje niejasne, do jakiego stopnia oligodendrogeneza trwa w różnych obszarach mózgu dorosłego człowieka. Analiza datowania węglem sugeruje, że większość oligodendrocytów w ciele modzelowatym powstaje we wczesnym dzieciństwie (Yeung i in., 2014). Analiza immunohistochemiczna ludzkiej tkanki mózgowej z użyciem nowego markera dla nowo zróżnicowanych oligodendrocytów (BCAS1) wykazuje nowe oligodendrocyty w korze czołowej nawet po przekroczeniu wieku średniego, ale bardzo niewiele nowych oligodendrocytów w istocie białej po trzeciej dekadzie życia (Fard i in., 2017). Ta różnica w oligodendrogenezie między gatunkami może być wynikiem skali. Dane Hughesa i wsp. (2013) dotyczące gryzoni sugerują, że oligodendrocyty są generowane w ogromnym nadmiarze, z ciągłym przycinaniem prawie 80% komórek. Biorąc pod uwagę koszt energetyczny takiego procesu, czy ten mechanizm jest możliwy do utrzymania przez całe życie w narządzie wielkości ludzkiego mózgu? Być może w ludzkim mózgu istnieje ograniczona nadprodukcja oligodendrocytów, z powodu potrzeby bardziej przedłużonej mielinizacji większego OUN, lub dlatego, że sygnały takie jak aktywność neuronów stymulują OPCs do różnicowania się w oligodendrocyty, jak i kiedy jest to wymagane.
Modelowanie mieliny
Modelowanie istniejących osłonek mielinowych mogłoby zmienić właściwości przewodzenia bez potrzeby generowania nowych oligodendrocytów lub mieliny. Zmiana długości istniejących osłonek mielinowych mogłaby zmienić pokrycie mielinowe wzdłuż aksonu i odległość między węzłami Ranviera (co wpłynęłoby na prędkości przewodzenia). Ponadto, nawet bardzo subtelna przebudowa mieliny może zmienić długość samych węzłów. Niedawno wykazano, że długość węzłów może się znacznie różnić w nerwie wzrokowym i w korze mózgowej, i że zmiana długości węzłów wzdłuż aksonu może, w zasadzie, również znacząco zmienić prędkość przewodzenia (Arancibia-Cárcamo i in., 2017). To, czy zmiany węzła Ranviera są przede wszystkim napędzane przez mielinizację, czy reorganizację samego aksonu, pozostaje do ustalenia.
Zarówno Hill i wsp. (2018), jak i Hughes i wsp. (2018) przeprowadzili podłużne badanie poszczególnych osłonek mielinowych w korze somatosensorycznej myszy przez kilka tygodni, aby ocenić, czy długości osłonek są dynamicznie regulowane. Hill i wsp. (2018) stwierdzili, że we wczesnej dorosłości (P90-120), chociaż niektóre osłonki wykazują wydłużenie lub kurczenie się, 81% obserwowanych osłonek było stabilnych. Więcej osłonek może stać się stabilnych w długości z wiekiem; Hughes i wsp. (2018) śledzili osłonki u starszych (P365) zwierząt i zauważyli, że 99% osłonek pozostało stabilnych w ciągu 3 tygodni (Figura 1B).
Podobna stabilność długości osłonek została również opisana w innym miejscu; Auer i wsp. (2018) wykorzystali larwalne zebrafish do zbadania, czy poszczególne osłonki mogą zmieniać długość w czasie, wykonując obrazowanie na żywo w czasie fluorescencyjnie znakowanych osłonek mielinowych. Stwierdzili oni, że poszczególne osłonki ulegają szybkiemu, ale zmiennemu wzrostowi w ciągu pierwszych kilku dni po uformowaniu, zanim ustabilizują swoją długość. Po ustabilizowaniu, osłonki tylko nadal rosną, aby pomieścić ogólny wzrost zwierzęcia.
Dlaczego niektóre osłonki w korze zmieniają długość, podczas gdy inne nie? Może to odzwierciedlać różnorodność w wymaganiach odrębnych obwodów neuronalnych. Różnorodność aksonalna została zaobserwowana podczas początkowej mielinizacji w rdzeniu kręgowym zebrafa, gdzie niektóre aksony wykorzystują uwalnianie pęcherzyków synaptycznych do regulowania liczby i długości osłonek mielinowych, podczas gdy inne nie (Koudelka i in., 2016). To rodzi intrygującą hipotezę, że tylko niektóre aksony są w stanie regulować mielinę poprzez sygnały związane z aktywnością. Hughes i wsp. (2018) stwierdzili, że ich paradygmat stymulacji sensorycznej nie zwiększył proporcji dynamicznych osłonek w korze somatosensorycznej. Jednak bardziej szczegółowa analiza różnorodności podtypów aksonów w połączeniu z podłużnym badaniem dynamiki długości osłonek mogłaby potwierdzić, czy remodelowanie długości osłonek jest specyficzne dla pewnych obwodów.
Czy stabilność długości osłonek odzwierciedla niezdolność osłonek do remodelowania? Eksperymenty na zebrafish sugerują, że remodelowanie długości osłonek może być indukowane, gdy profil mielinizacji aksonu jest zaburzony. Auer i wsp. (2018) dokonali ablacji pojedynczych oligodendrocytów, przez co skąpo usunęli osłonki wzdłuż aksonów. Odkryli, że gdy pojedyncza otoczka mielinowa została utracona na w pełni mielinizowanym aksonie, sąsiednie otoczki mogą ponownie zainicjować szybki wzrost, aby pokryć niezmelinizowaną lukę. W kilku przypadkach nowa osłonka mielinowa tworzyła się w miejsce swojej poprzedniczki i mogła nawet naciskać z powrotem na inwazyjne sąsiednie osłonki, aby przywrócić oryginalny wzór mielinizacji (Figura 2A). Dlatego czasami specyficzny wzorzec mielinizacji jest preferencyjnie utrzymywany, nawet po przerwaniu mieliny. Może to mieć na celu podtrzymanie zoptymalizowanych właściwości przewodzenia leżącego u podstaw aksonu. Auer i wsp. (2018) zaobserwowali słabo mielinizowane aksony w larwalnej zebrafish, tak jak wcześniej zidentyfikowano je w korze gryzoni. Co ciekawe, odkryli, że po ablacji pojedynczych osłonek na takich słabo mielinizowanych aksonach nowa osłonka tworzyła się praktycznie w tym samym miejscu, co ablowana osłonka, nawet wzdłuż skądinąd niemielinizowanego odcinka aksonu (Figura 2B). Tak więc wzory mielinizacji wzdłuż słabo mielinowanych aksonów również wydają się być stabilnie utrzymywane u zebrafish, jak sugerują Hill i in. (2018) u gryzoni. Funkcja profili sparse myelination pozostaje nieznana. Takie wzorce mogą umożliwić bardziej dynamiczne dostrajanie funkcji pojedynczego aksonu w czasie, chociaż możliwe jest również, że takie niezmelinowane przerwy mogą ułatwiać stopniową mielinizację w celu utrzymania stałych czasów przewodzenia w obwodach, ponieważ zwierzę rośnie i / lub zmieniają się długości aksonów.
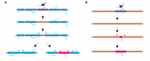
FIGURE 2. Remodelowanie mieliny może zachodzić in vivo. (A) Ablacja pojedynczych osłonek na w pełni mielinizowanym aksonie może wywołać szybki wzrost sąsiednich osłonek, aby pokryć powstałą lukę. Ta luka może być albo całkowicie pokryta przez sąsiednie osłonki, albo pierwotny profil mielinizacji może być przywrócony przez dodanie nowej osłonki. (B) Po ablacji osłonki na słabo mielinizowanym aksonie następuje formowanie nowej osłonki mielinowej o identycznym rozmiarze i położeniu jak ablowana poprzednia osłonka. Podsumowanie danych z Auer i wsp. (2018).
Czy stabilne osłonki mielinowe u ssaków również mają tę zdolność do remodelowania, gdy wzór mielinizacji jest zaburzony? Dalsze badania podłużne w połączeniu z demielinizacją są wymagane, aby odpowiedzieć na to pytanie. Jest możliwe, że taka przebudowa nie jest indukowana przez aktywność neuronów, ale jest mechanizmem kompensacyjnym dla utraty mieliny. Związana z wiekiem utrata oligodendrocytów mogłaby wywołać remodelowanie ocalałych osłonek, aby pokryć zdenudowane fragmenty aksonu i w ten sposób pomóc w utrzymaniu funkcji obwodu. Żywe obrazowanie osłonek mielinowych w starszym wieku mogłoby określić, czy tak jest.
Omawiane tutaj badania żywego obrazowania wszystkie oceniły dynamikę długości osłonek mielinowych, ale nie grubość osłonek mielinowych. Czy grubość osłonki może być dynamicznie regulowana? Stymulacja sygnalizacji PI3K/AKT/mTOR w oligodendrocytach dorosłych myszy wyzwala dodatkowe zawijanie mieliny w celu zwiększenia grubości osłonki (Snaidero i in., 2014). Może to być modulowane przez aktywność obwodu, ponieważ stymulacja neuronów prowadzi do zwiększenia grubości osłonki zarówno u młodych, jak i dorosłych myszy (Gibson i in., 2014; Mitew i in., 2018). Podkreśla to potrzebę długoterminowego obrazowania wszystkich parametrów osłonki, aby w pełni zrozumieć dynamikę remodelingu osłonki. Istnieje zapotrzebowanie na modalności obrazowania przyżyciowego w celu dokładnego pomiaru grubości osłonki wzdłuż aksonów, ponieważ obecnie wymaga to pomiaru przekrojowego za pomocą mikroskopii elektronowej, co ogranicza analizę do pojedynczego punktu czasowego. Niektóre techniki obrazowania bez etykiet, takie jak mikroskopia trzeciej generacji harmonicznej i reflektometria spektralna, okazują się obiecujące do wykonywania takich pomiarów (Lim i in., 2014; Kwon i in., 2017). Sprzężenie tych technik z badaniami podłużnymi kory mózgowej gryzoni mogłoby określić, czy ustalone powłoki mielinowe mogą dostosować swoją grubość, czy też aktywność neuronów po prostu popycha de novo mielinizację, aby wytworzyć grubsze powłoki.
Wydaje się zatem, że chociaż powłoki mielinowe są zdolne do przebudowy, gdy mielina jest zakłócona, większość powłok jest ogólnie stabilna w długości. Ta stabilność jest potencjalnie spowodowana utrzymaniem wcześnie ustalonych wzorców mielinizacji zoptymalizowanych dla funkcji obwodu.
Przyszłość
Ostatnie badania obrazowania ssaków skupiły się na mielinizacji de novo i przebudowie osłonek w korowej istocie szarej. Obwody korowe otrzymują i wysyłają informacje przez wiele regionów, takich jak rdzeń kręgowy i ciało modzelowate, a więc zmiany mieliny w kilku różnych obszarach OUN mogą zmieniać sygnalizację w pojedynczym obwodzie. OUN jest tradycyjnie opisywany na podstawie wyglądu po utrwaleniu w formaldehydzie, gdzie „istota biała” opisuje silnie mielinizowane szlaki aksonalne, podczas gdy „istota szara” opisuje regiony gęsto upakowane ciałami komórek neuronów, dendrytami i synapsami. Jednak ta klasyfikacja jest zbyt uproszczona; OPC wytwarzają mielinizujące oligodendrocyty zarówno w istocie szarej, jak i białej (Dawson i in., 2003), i w rzeczywistości pojawiają się dowody na różnorodność w linii oligodendroglejowej i we wzorcach mielinizacji zarówno w istocie szarej, jak i białej (Rivers i in., 2008; Viganò i in., 2013; Young i in., 2013; Bechler i in., 2015). Taka różnorodność może odzwierciedlać unikalne wymagania mieliny w odrębnych obszarach, i potencjalnie na odrębnych obwodach, OUN. Dalsze podłużne badania obrazowania są wymagane, aby lepiej zrozumieć dynamikę mielinizacji de novo i remodelowania osłonki w obszarach OUN poza korą.
Podczas gdy optyczna przejrzystość larwalnej zebrafish nadaje się do nieinwazyjnego obrazowania na żywo, wykonywanie takich eksperymentów w OUN ssaków jest bardziej inwazyjne i technicznie trudne. Hill et al. (2018) oraz Hughes et al. (2018) wykorzystali mikroskopię dwufotonową z oknami obrazowania czaszkowego do obrazowania głębokości do 400 μm w głąb kory mózgowej. Podobne techniki mogą być stosowane do obrazowania powierzchownych mielinizowanych traktów w rdzeniu kręgowym w czasie (Locatelli i in., 2018), ale głębsze regiony OUN nie mogą być penetrowane przez samą mikroskopię dwufotonową. Jedną z alternatyw jest zastosowanie mikroendoskopii dwufotonowej, w której sonda mikroendoskopowa z soczewką o gradientowym współczynniku załamania światła (GRIN) jest wprowadzana do tkanki w celu obrazowania komórek głębiej w mózgu . Jednakże, wprowadzenie endoskopu może prowadzić do reakcji zapalnych, które mogą wpływać na mielinizację. Alternatywą może być mikroskopia trójfotonowa wykorzystująca metodę okna obrazowania czaszkowego, która była również wcześniej stosowana do obrazowania hipokampa (Horton i in., 2013; Ouzounov i in., 2017). Mikroskopia trójfotonowa daje znacznie większy stosunek sygnału do tła niż mikroskopia dwufotonowa i dlatego może być stosowana do obrazowania głębszych struktur tkankowych.
Szczególnie ważne jest uwzględnienie nie tylko różnych regionów OUN, ale także różnych neuronów w obrębie tych regionów. Poprzednie badania sugerują, że istnieją mechanistyczne różnice w tym, jak odrębne podtypy neuronów regulują swoją mielinizację (Koudelka i in., 2016). Dodatkowo, może istnieć różnorodność w lokalnej regulacji mieliny. Istotne jest, aby pamiętać, że różne części OUN nie są oddzielnymi jednostkami, ale są wzajemnie połączone. Integracja mezoskalowej connectomiki, która skupia się na zrozumieniu połączeń różnych podtypów neuronów w różnych regionach (Zeng, 2018), będzie kluczowa dla naszego zrozumienia, w jaki sposób dynamika mielinizacji przez całe życie różni się w różnych obwodach.
Jaka jest funkcjonalna konsekwencja regulacji mieliny wzdłuż odrębnych obwodów? Jak dotąd, funkcjonalne implikacje mogą być jedynie wywnioskowane przez korelacje z zachowaniem. Ostatecznie, istnieje potrzeba połączenia pomiaru dynamiki mieliny z bezpośrednią oceną aktywności obwodów. Będzie to wymagało rejestrowania aktywności neuronów podczas podłużnych badań mielinizacji, aby bezpośrednio połączyć obserwowaną mielinizację de novo lub remodelowanie osłonki ze zmianami funkcji obwodu w czasie. Ważne będzie mierzenie dynamiki mieliny i aktywności elektrofizjologicznej pojedynczych neuronów i aksonów w celu określenia, w jaki sposób zmiany różnych parametrów osłonki mielinowej rzeczywiście wpływają na właściwości przewodzenia na poziomie pojedynczej komórki, jak również ocena aktywności na poziomie populacji. Narzędzia takie jak genetycznie kodowane wskaźniki Ca2+ lub napięcia pozwalają na stosunkowo nieinwazyjną rejestrację aktywności obwodów, a nawet mogą być wykorzystywane do oceny aktywności obwodów w całym mózgu (Ahrens i in., 2012; Lovett-Barron i in., 2017).
Podsumowanie
Mielinizacja aksonów stanowi potężny potencjalny mechanizm regulacji funkcji obwodów przez całe życie. Badania wykazały, że mielinizacja de novo w korze mózgowej (poprzez produkcję nowych oligodendrocytów) występuje nawet w wieku dorosłym, i że można ją wzmocnić poprzez stymulację aktywności obwodu. Po uformowaniu się mieliny jest ona stabilna, z niewielką rotacją oligodendrocytów i ograniczoną przebudową długości istniejących osłonek mielinowych. Jednakże te stabilne struktury mogą zachować zdolność do przebudowy, jeśli mielina zostanie zaburzona. Ma to interesujące implikacje dotyczące plastyczności mieliny w utrzymaniu funkcji obwodów w czasie urazu, choroby i starości. Nie wiadomo dokładnie, w jaki sposób zmiany w mielinizacji wpływają na funkcjonowanie obwodów, które leżą u ich podstaw. Ostatecznie, podejście na poziomie obwodu, integrujące analizę dynamiki mieliny z bezpośrednim pomiarem funkcji obwodu, jest wymagane, aby w pełni docenić, jak dynamiczna mielinizacja wpływa na ogólną funkcję układu nerwowego przez całe życie.
Wkład autorów
Wszyscy wymienieni autorzy wnieśli znaczący, bezpośredni i intelektualny wkład w pracę i zatwierdzili ją do publikacji.
Fundacje
DAL jest wspierany przez Wellcome Trust Senior Research Fellowship (102836/Z/13/Z). JMW jest wspierany przez University of Edinburgh Ph.D. Tissue Repair Studentship Award (MRC Doctoral Training Partnership MR/K501293/1) i Wellcome Trust Four-Year Ph.D. Program in Tissue Repair (Grant 108906/Z/15/Z).
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Brain-wide neuronal dynamics during motor adaptation in zebrafish. Nature 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., and Lyons, D. A. (2017). On myelinated axon plasticity and neuronal circuit formation and function. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K., and Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). Dowody na remodeling osłonki mielinowej w OUN ujawnione przez obrazowanie in vivo. Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Cell death and control of cell survival in the oligodendrocyte lineage. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015). CNS myelin sheath lengths are an intrinsic property of oligodendrocytes. Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., and Trapp, B. D. (2000). NG2-pozytywne oligodendrocyte progenitorowe komórki w dorosłym ludzkim mózgu i zmianach stwardnienia rozsianego. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Ageing and brain white matter structure in 3,513 UK Biobank participants. Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., and Lyons, D. A. (2013). Individual oligodendrocytes have only a few hours in which to generate new myelin sheaths in vivo. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., and Reynolds, R. (2003). NG2-expressing glial progenitor cells: an abundant and widespread population of cycling cells in the adult rat CNS. Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). BCAS1 expression defines a population of early myelinating oligodendrocytes in multiple sclerosis lesions. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Nowy mechanizm plastyczności układu nerwowego: mielinizacja zależna od aktywności. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). Neuronal activity promotes oligodendrogenesis and adaptive myelination in the mammalian brain. Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., and Grutzendler, J. (2018). Lifelong cortical myelin plasticity and age-related degeneration in the live mammalian brain. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., and Nishiyama, A. (2014). Modulation of oligodendrocyte generation during a critical temporal window after NG2 cell division. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. (2013). In vivo three-photon microscopy of subcortical structures within an intact mouse brain. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). Mutant huntingtin downregulates myelin regulatory factor-mediated myelin gene expression and affects mature oligodendrocytes. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M., and Bergles, D. E. (2013). Oligodendrocyte progenitors balance growth with self-repulsion to achieve homeostasis in the adult brain. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., and Bergles, D. E. (2018). Myelin remodeling through experience-dependent oligodendrogenesis in the adult somatosensory cortex. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., and Schnitzer, M. J. (2004). In vivo mammalian brain imaging using one- and two-photon fluorescence microendoscopy. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). Degeneration and impaired regeneration of gray matter oligodendrocytes in amyotrophic lateral sclerosis. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Individual neuronal subtypes exhibit diversity in CNS myelination mediated by synaptic vesicle release. Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). Sygnalizacja przez receptory AMPA na prekursorach oligodendrocytów promuje mielinizację poprzez zwiększanie przeżywalności oligodendrocytów. eLife 6:e28080. doi: 10.7554/eLife.28080
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Label-free nanoscale optical metrology on myelinated axons in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., and Webb, W. W. (2004). In vivo multiphoton microscopy of deep brain tissue. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., and Melendez-Vasquez, C. V. (2014). Label-free imaging of Schwann cell myelination by third harmonic generation microscopy. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Mononuklearne fagocyty lokalnie określają i dostosowują swój fenotyp w modelu stwardnienia rozsianego. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Ancestral circuits for the coordinated modulation of brain state. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., and Rockel, C. (2006). White matter growth as a mechanism of cognitive development in children. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). Motor skill learning requires active central myelination. Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). Farmakogenetyczna stymulacja aktywności neuronów zwiększa mielinizację w sposób specyficzny dla aksonów. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., and Monje, M. (2017). Zawinięte, aby się dostosować: mielinizacja zależna od doświadczenia. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). In vivo three-photon imaging of activity of GCaMP6-labeled neurons deep in intact mouse brain. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Coupled changes in brain white matter microstructure and fluid intelligence in later life. J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). PDGFRA/NG2 glia generate myelinating oligodendrocytes and piriform projection neurons in adult mice. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). Motor skill learning induces changes in white matter microstructure and myelination. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). Relations between white matter maturation and reaction time in childhood. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., and Grutzendler, J. (2014). Bezetykietowe obrazowanie in vivo mielinowanych aksonów w zdrowiu i chorobie za pomocą spektralnej konfokalnej mikroskopii refleksyjnej. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., and Johansen-berg, H. (2009). Training induces changes in white-matter architecture. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). Myelin membrane wrapping of CNS axons by PI(3,4,5)P3-dependent polarized growth at the inner tongue. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., and Buxbaum, J. D. (2011). Linking oligodendrocyte and myelin dysfunction to neurocircuitry abnormalities in schizophrenia. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. (2014). Distinct profiles of myelin distribution along single axons of pyramidal neurons in the neocortex. Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., and Richardson, W. D. (2017). Remarkable stability of myelinating oligodendrocytes in mice. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., and Dimou, L. (2013). Transplantacja ujawnia regionalne różnice w różnicowaniu oligodendrocytów w dorosłym mózgu. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., and Barres, B. A. (2008). Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Determinants of conduction velocity in myelinated nerve fibers. Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). Rapid production of new oligodendrocytes is required in the earliest stages of motor-skill learning. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Dynamics of oligodendrocyte generation and myelination in the human brain. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Oligodendrocyte dynamics in the healthy adult CNS: evidence for myelin remodeling. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Mesoscale connectomics. Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar
.