Czy zastanawiałeś się kiedyś, dlaczego świecące pałeczki (patrz Rys. 1) świecą po tym, jak je zgiąłeś? Albo dlaczego te plastikowe gwiazdki świecą jeszcze w nocy po wyłączeniu świateł? Możliwe, że nie. Jednak bez względu na to, czy zadawałeś sobie te pytania, czy nie, poniższy tekst, miejmy nadzieję, dostarczy ci odpowiedzi i wyjaśnień na temat zjawisk świecących bransoletek, świecących meduz, czarnego światła i wielu innych.

Rysunek 1. Jarzące się pałeczki.
Luminescencja
W ogólności, blask występujący we wszystkich wyżej wymienionych zjawiskach nazywamy luminescencją. Luminescencja to energia uwalniana przez substancję w postaci światła . Można rozróżnić kilka rodzajów luminescencji:
- Jednym z przykładów jest chemiluminescencja. Podczas niektórych reakcji chemicznych, energia jest uwalniana w postaci światła. Dzieje się tak po zgięciu świecącego kija. Jest to również przyczyna świecenia zwierząt takich jak meduzy lub niektóre mikroorganizmy. W tym przypadku nazywa się to bioluminescencją .
- Innym rodzajem jest triboluminescencja. Można ją zaobserwować, gdy samoprzylepna koperta jest otwierana w zupełnej ciemności lub gdy taśma klejąca jest rozwijana w ciemnym pomieszczeniu. W ten sposób energia mechaniczna jest wprowadzana do systemu i służy jako aktywator dla świecenia .
- Prawdopodobnie najbardziej znanym rodzajem luminescencji jest fotoluminescencja. Tutaj energia jest dostarczana przez promieniowanie elektromagnetyczne, na przykład przez światło słoneczne lub lampę ultrafioletową, jak w niektórych dyskotekach. Powoduje to takie zjawiska jak ciągłe świecenie plastikowych gwiazd lub ekstremalną jasność białych ubrań w czarnym świetle. Można rozróżnić fluorescencję i fosforescencję, co zostanie wyjaśnione poniżej .
Co to jest elektronowo wzbudzony stan?
Ogólnie rzecz biorąc, wszystkie rodzaje luminescencji są oparte na tak zwanych procesach fotofizycznych. Zazwyczaj same cząsteczki są opisywane jako fluorescencyjne. Tak jest w przypadku barwników fluorescencyjnych, takich jak fluoresceina czy kurkumina. Jednak, aby wyjaśnić procesy fotofizyczne, należy przyjrzeć się jeszcze mniejszemu poziomowi niż molekularny.
Atomy różnych pierwiastków mają różną liczbę elektronów rozmieszczonych w kilku powłokach i orbitalach. Elektrony są rodzajem cząstki elementarnej. Przejścia elektronowe są odpowiedzialne za luminescencję . Gdy układ absorbuje energię, elektrony są wzbudzane i podnoszone do wyższego stanu energetycznego. Przed wzbudzeniem, w stanie podstawowym, część elektronów znajduje się w tzw. HOMO (Highest Occupied Molecular Orbital). Po osiągnięciu stanu wzbudzonego, znajdują się one w LUMO (Lowest Unoccupied Molecular Orbital) (patrz Rys. 2). Jak to dokładnie działa zostanie wyjaśnione na przykładzie fotoluminescencji.

Rysunek 2. Wzbudzenie elektroniczne.
Różne stany energetyczne atomu lub cząsteczki znane są jako „poziomy energetyczne”. W zależności od cząsteczki i atomu, elektrony mogą zajmować tylko dyskretne poziomy energetyczne, ponieważ energia jest skwantowana, co oznacza, że energia może być absorbowana i emitowana tylko w pewnych ilościach. Różnicę między dwoma poziomami można obliczyć za pomocą równania 1 (gdzie E2 jest wyższym poziomem energetycznym, a E1 niższym).
(1) ΔE = E2-E1
Fotony, cząstki, z których składa się promieniowanie elektromagnetyczne lub światło, muszą mieć określoną wartość energii, aby mogły wzbudzić elektrony. Energię fotonu można obliczyć za pomocą równania 2, gdzie h jest stałą Plancka, a ν jest częstotliwością światła.
(2) Efoton = hν
Niezbędna energia wzbudzenia dla elektronów jest równa różnicy pomiędzy poziomami energetycznymi. Tylko światło o określonej energii, a co za tym idzie o określonej częstotliwości i długości fali, jest w stanie wzbudzić elektrony . Poprzez zrównanie równań 1 i 2, oraz przy pomocy równania 3 (gdzie c oznacza prędkość światła), niezbędna częstotliwość i długość fali może być obliczona (patrz równanie 4). W wielu przypadkach do wzbudzania stosuje się promieniowanie UV.
(3) λ = c/ν
(4) ΔE = Efoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Dezaktywacja elektronowo wzbudzonych stanów
Takie elektronowo wzbudzone stany są niestabilne. Elektrony opadają z powrotem do swoich stanów podstawowych. W tym samym czasie energia wzbudzenia jest ponownie uwalniana. Rozróżnia się radiacyjne i nieradiacyjne procesy rozpadu. W większości przypadków rozpad jest nieradiacyjny, na przykład poprzez relaksację wibracyjną, wygaszanie przez otaczające cząsteczki lub konwersję wewnętrzną (IC). Procesy te zostaną szczegółowo wyjaśnione później.
Niekiedy może wystąpić rozpad promieniotwórczy w postaci fluorescencji i fosforescencji. Energia jest emitowana jako promieniowanie elektromagnetyczne lub fotony. Emitowane światło ma większą długość fali i niższą energię niż światło zaabsorbowane, ponieważ część energii została już uwolniona w procesie rozpadu nieradiacyjnego. Jest to powód, dla którego emisja w spektrum widzialnym może być osiągnięta poprzez wzbudzenie niewidzialnym promieniowaniem UV. To przesunięcie w kierunku większej długości fali nazywane jest przesunięciem Stokesa .
Porównanie: Fluorescencja vs. Fosforescencja
Zarówno fluorescencja jak i fosforescencja są spontanicznymi emisjami promieniowania elektromagnetycznego. Różnica polega na tym, że blask fluorescencji ustaje zaraz po wyłączeniu źródła promieniowania wzbudzającego, podczas gdy w przypadku fosforescencji może wystąpić poświata o czasie trwania od ułamków sekundy do godzin .
Aby porównać procesy fotofizyczne stojące za obydwoma zjawiskami, należy zapoznać się z pewnymi faktami dotyczącymi elektronów, które są pomocne w ich zrozumieniu: Elektrony są cząstkami, które mają tzw. spin i spinową liczbę kwantową. Liczba ta może mieć dwie różne wartości, mianowicie albo +1/2 albo -1/2 . Liczba ta jest właściwością, której właściwie nie możemy sobie wyobrazić ani łatwo opisać. Często porównuje się ją do wirującego bączka, obracającego się w kierunku zgodnym lub przeciwnym do ruchu wskazówek zegara. Jednak ten opis nie jest ani matematycznie, ani fizycznie poprawny. Dwa elektrony w pojedynczym orbitalu atomu mają spin antyrównoległy, co zapisuje się jako (↓) .
Fluorescencja
Na diagramie Jabłońskiego dla fluorescencji (patrz Rys. 3), singletowy stan spinowy S0 jest stanem podstawowym elektronów, a S1 i S2 są singletowymi stanami wzbudzonymi (stany te są użyte tylko jako przykład w tym tekście i nie muszą dotyczyć określonych atomów, molekuł, itp.) W ramach tych stanów istnieje kilka poziomów energetycznych. Im wyższy jest poziom, tym więcej energii posiada elektron znajdujący się na tym poziomie. W przypadku stanów singletowych, elektrony mają spiny antyrównoległe.

Rysunek 3. Diagram Jabłońskiego dla fluorescencji.
Pod wpływem wzbudzenia promieniowaniem elektromagnetycznym elektrony są unoszone ze stanu podstawowego S0, na przykład do poziomu energetycznego drugiego stanu wzbudzonego S2. Po ustaniu wzbudzenia elektrony pozostają w tym stanie wzbudzonym tylko przez krótki okres czasu (ok. 10-15 s), po czym natychmiast zaczynają opadać z powrotem do stanu podstawowego. W ten sposób energia może być początkowo uwolniona do otoczenia poprzez relaksację wibracyjną. Oznacza to, że energia termiczna jest uwalniana przez ruch atomu lub cząsteczki, aż do osiągnięcia najniższego poziomu drugiego stanu wzbudzonego.
Większa luka pomiędzy drugim i pierwszym stanem wzbudzonym jest pokonywana przez konwersję wewnętrzną. To opisuje przejście elektroniczne między dwoma stanami, podczas gdy spin elektronów jest zachowany. Teraz, elektrony mogą się dalej relaksować dzięki większej relaksacji wibracyjnej, aż osiągną najniższy poziom energetyczny stanu S1.
Teoretycznie, elektrony mogą relaksować się jeszcze bardziej w sposób nieradiatywny, aż w końcu ponownie osiągną stan podstawowy. Może się jednak zdarzyć, że ostatnia ilość energii jest zbyt duża, aby mogła zostać uwolniona do otoczenia, ponieważ otaczające cząsteczki nie są w stanie zaabsorbować tak dużej ilości energii. Wówczas zachodzi fluorescencja, która prowadzi do emisji fotonów o określonej długości fali. Emisja ta trwa tylko do momentu powrotu elektronów do stanu podstawowego. Ponieważ podczas wszystkich tych przejść spin elektronu pozostaje niezmieniony, są one określane jako spin-allowed .
Fosforescencja
W przypadku fosforescencji sprawy mają się nieco inaczej (patrz Rys. 4). Znów występuje stan podstawowy S0 i dwa stany wzbudzone, S1 i S2. Dodatkowo, istnieje wzbudzony stan trypletowy T1, który energetycznie leży pomiędzy stanami S0 i S1. W stanie podstawowym elektrony znów mają spiny antyrównoległe.
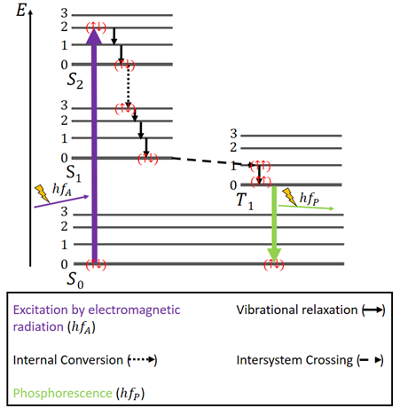
Rysunek 4. Diagram Jabłońskiego dla fosforescencji.
Wzbudzenie zachodzi w taki sam sposób jak we fluorescencji, czyli poprzez promieniowanie elektromagnetyczne. Uwalnianie energii poprzez relaksację wibracyjną i konwersję wewnętrzną przy zachowaniu tego samego spinu jest tu również takie samo, ale tylko do momentu osiągnięcia stanu S1.
Obok stanów singletowych istnieje stan trypletowy i może dojść do tzw. przejścia międzysystemowego (ISC), ponieważ stan T1 jest energetycznie korzystniejszy od stanu S1. To przejście, podobnie jak konwersja wewnętrzna, jest przejściem elektronowym pomiędzy dwoma stanami wzbudzonymi. Jednak w przeciwieństwie do konwersji wewnętrznej, ISC jest związane z odwróceniem spinu z singletowego do trypletowego. Elektrony w stanie trypletowym mają równoległe spiny, co jest odnotowywane jako () . Ten proces ISC określany jest jako „spin-forbidden”. Nie jest on całkowicie niemożliwy – ze względu na zjawisko zwane „sprzężeniem spin-orbita” – jednak jest raczej mało prawdopodobny .
W stanie T1 możliwy jest również rozpad nieradiatywny. Natomiast przejście między najniższym poziomem energetycznym stanu trypletowego a stanem S0 nie jest łatwo możliwe, bo to przejście też jest zabronione spinowo. Mimo to, z niewielkim prawdopodobieństwem może ono nastąpić. Powoduje ono raczej słabą emisję fotonów, ponieważ spin elektronu musi być ponownie odwrócony. Energia zostaje na chwilę uwięziona w tym stanie i może być uwolniona tylko powoli. Po uwolnieniu całej energii elektrony wracają do stanu podstawowego .
Wniosek
Procesy dozwolony i zabroniony spinowo służą jako wyjaśnienie dla natychmiastowego ustania blasku fluorescencji i dla poświaty fosforescencji. Fosforescencja występuje zwykle tylko w „cięższych” cząsteczkach, ponieważ spin musi być odwrócony za pomocą sprzężenia spin-orbita. To, czy promieniowanie elektromagnetyczne zostanie w ogóle wyemitowane i o jakiej długości fali, zależy od tego, ile energii może zostać wcześniej uwolnione w wyniku rozpadu niepromienistego. Zależy to również od właściwości tzw. quencherów, które otaczają cząsteczki i są w stanie przejąć większe ilości energii.
Wszystkie procesy, które mogą prowadzić do zahamowania rozpadów promieniotwórczych mogą powodować wygaszanie fluorescencji. Przykładem są procesy rozpadu nieradiacyjnego, ale także destrukcja cząsteczki fluorescencyjnej. Wydajność kwantowa opisuje efektywność procesu i jest definiowana jako stosunek fotonów zaabsorbowanych i wyemitowanych. Ta właściwość jest inna dla każdej substancji.
Mimo że ten tekst koncentruje się na fotoluminescencji, procesy fotofizyczne są takie same dla wszystkich rodzajów luminescencji .
Zastosowania
Oprócz produktów takich jak świecące pałeczki, fluorescencja i fosforescencja są wykorzystywane na wiele innych sposobów. Dalsze przykłady to drogowskazy prowadzące do wyjścia awaryjnego, które nie wymagają zasilania elektrycznego, ale świecą w nocy z powodu fosforescencji. Nawet rośliny mogą stać się fluorescencyjne: Szpinak można zmodyfikować za pomocą nanotechnologii tak, aby mógł wykrywać ślady substancji wybuchowych w wodach gruntowych. Liście zawierają nanorurki węglowe, z którymi mogą łączyć się nitroaromaty. Jeśli tak się stanie, roślina uwalnia sygnał fluorescencyjny, który można wykryć za pomocą kamer na podczerwień .
Wideo demonstruje różne rodzaje luminescencji. Po lewej stronie, pokazuje fluorescencję barwnika kurkuminy, który jest zawarty w przyprawie kurkuma, w świetle UV . Kurkumina jest rozpuszczona w alkoholu, aby fluorescencja była widoczna.
Plastikowy pająk i związek w małej probówce są przykładami fosforescencji. Glinian strontu, który znajduje się w probówce, jest początkowo wzbudzany przez promieniowanie UV i ostatecznie emituje zielone światło. Przyczyną tego jest domieszkowanie pierwiastkami takimi jak europ, co czyni związek użytecznym jako pigment luminescencyjny.
Zginanie pałeczki jarzeniowej (po prawej stronie) inicjuje reakcję chemiczną między nadtlenkiem wodoru a barwnikiem i szczawianem fenylu. Można zaobserwować chemiluminescencję.
Wideo 1. Fluorescencja, fosforescencja i chemiluminescencja w porównaniu.
K. Arnold et al., Chemie Oberstufe (in German), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (w języku niemieckim), spektrum.de. (dostęp 25.01.2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (w języku niemieckim), chemieunterricht.de 2010. (dostęp 25.01.2017)
Lexikon der Physik: Photophysikalische Prozesse (w języku niemieckim), spektrum.de. (dostęp 27 stycznia 2017 r.)
D. Wiechoczek, Chemie mit Curry (w języku niemieckim), chemieunterricht.de 2015. (dostęp 27 stycznia 2017 r.)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (w języku niemieckim), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (po niemiecku), chemie.de. (dostęp 27.01.2017)
Relacja częstotliwości Bohra (w języku niemieckim), chemgapedia.de. (dostęp 25.01.2017)
Ilmenau University of Technology, Practical Course Physical Chemistry II: Physical Chemistry/Microreaction Technology, Fluorescence Quenching Experiment (in German), tu-ilmenau.de. (dostęp 27.01.2017)
Przesunięcie Stokesa (w języku niemieckim), chemie.de. (dostęp 25.01.2017)
Spin elektronu (w języku niemieckim), chemie.de. (dostęp 27.01.2017)
Wydajność kwantowa (w języku niemieckim), chemie.de. (dostęp 27 stycznia 2017 r.)
Szpinak wykrywa materiały wybuchowe w wodach gruntowych (w języku niemieckim), Spiegel Online, 1 listopada 2016 r. (dostęp 27.01.2017)
D. Weiß, Phosphorescence (po niemiecku), chemie.uni-jena.de. (dostęp 27.01.2017)
 Kim Dreier jest uczennicą Marianne-Weber-Gymnasium (szkoła średnia) w Lemgo, Niemcy.
Kim Dreier jest uczennicą Marianne-Weber-Gymnasium (szkoła średnia) w Lemgo, Niemcy.
.