Aminotransferaza asparaginianowa autorstwa Luke’a Spoonera
Zawartość
- 1 Funkcja
- 2 Struktura
- 3 Funkcja
- 4 Zastosowania kliniczne
- 5 Struktury 3D aminotransferazy asparaginianowej
.
Funkcja
Aminotransferaza asparaginianowa (AAT), znana również jako transaminaza glutaminianowo-asparaginowa, transaminaza glutaminianowo-octowa, aminotransferaza prephenate i transaminaza A, jest enzymem należącym do klasy I rodziny aminotransferaz zależnych od pirydoksalu i fosforanu. Jest on kodowany przez gen GOT1. Jest to homodimer o długości 413 aminokwasów, który odgrywa kluczową rolę w metabolizmie aminokwasów i węglowodanów, ureogenezie oraz przenoszeniu równoważników redukujących do mitochondriów i chloroplastów. W komórkach prokariotycznych występuje wyłącznie w cytozolu, natomiast w komórkach eukariotycznych istnieją izozymy cytozolowe, mitochondrialne i chloroplastowe. Dwufunkcyjna aminotransferaza asparaginianowa (BAAT) jest wymagana do transaminacji prefanatu w arogenat.
W organizmie człowieka jest produkowana w mózgu, mięśniach szkieletowych, wątrobie, trzustce, krwinkach czerwonych i nerkach. Szeroki zakres tkanek, w których jest on wytwarzany, oddziela go od podobnego enzymu transaminazy alaninowej (ALT), który znajduje się głównie w wątrobie. Poziom AAT w organizmie może być stosowany jako marker dla choroby lub uszkodzenia tkanki. Jak również, AAT i ALT poziomy mogą być porównywane, aby wskazać, czy uszkodzenie tkanki znajduje się głównie w wątrobie.
Struktura
, który zawiera (Alpha Helices, Beta Strands , Loops , Turns). Asymetryczna jednostka aminotransferazy asparaginianowej, z uwypukloną małą i dużą domeną oraz kofaktorem PLP (1b4x). Każda podjednostka zawiera równoważne miejsce aktywne. Podjednostki łączą się w dwóch miejscach: pomiędzy swoimi dużymi domenami oraz pomiędzy resztami N-końcowymi i dużą domeną na drugiej podjednostce. Struktura AST różni się nieznacznie u różnych organizmów, począwszy od E. coli, a skończywszy na człowieku. Również struktura miejsca aktywnego jest bardzo dobrze zachowana, a homologia sekwencji wynosi 25%.
Każda podjednostka homodimeru jest dalej podzielona na małą i dużą domenę. Mała domena składa się z aminokwasów od N-końca do reszty Pro 48 i od Met 326 do C-końca. Pozostałe aminokwasy tworzą domenę , a domeny są połączone długą helisą α składającą się z 32 aminokwasów.
Duża domena jest miejscem, w którym znajduje się miejsce aktywne AAT i aby to pomieścić, rdzeń zawiera wiele struktur α/β supersekundarnych. Kontrastuje to z rdzeniem małej podjednostki, który jest utworzony z dwóch α-helikali i dwóch β-strandów. W organizmach wielokomórkowych występuje załamanie przy 325 reszcie, które działa jak zawias dla małej domeny, co pozwala na wynikające z tego zmiany konformacyjne, które zachodzą przy wiązaniu inhibitorów do enzymu.
Jak stwierdzono powyżej, miejsce aktywne AST znajduje się na dużej domenie podjednostki. W obrębie miejsca aktywnego znajduje się reszta aminowa Lys 258, znana również jako wewnętrzna aldimina, która wiąże się z kofaktorem 5′-fosforanem pirydoksalu (), tworząc tak zwaną zasadę Schiffa. Po dodaniu substratu aminokwasowego, nowa zasada Schiiffa tworzy się między PLP i aminokwasem.
Funkcja
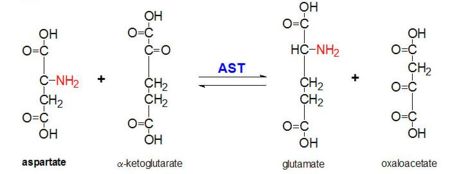
Ryc. 2: Reakcja transaminacji L-asparaginianu i α-ketoglutaranu katalizowana przez aminotransferazę asparaginianową
AAT katalizuje odwracalną transaminację grupy α-aminowej z L-asparaginianu do α-ketoglutaranu tworząc oksalooctan i glutaminian. Reaktywność ta jest niższa u E.coli niż u wyższych eukariontów i ma szerszą specyficzność substratową. Reakcja przebiega jednak w ten sam sposób. Po wprowadzeniu substratu aminokwasowego, pomiędzy nim a kofaktorem PLP tworzy się nowa zasada Schiffa. Powoduje to utratę wodoru przez aminokwas i utworzenie pośredniego chinidu, a następnie reprotanację, w wyniku której powstaje ketimina. Następnie struktura ta ulega hydrolizie tworząc kwas α-keto i fosforan pirydoksaminy. 2-metyloasparaginian działa jako inhibitor AAT, gdy tworzy zasadę Schiifa z kofaktorem PLP, a nie z asparaginianem. Powoduje to zatrzymanie procesu na etapie poprzedzającym eliminację białka alfa.
Reakcja ta jest niezbędna do utrzymania homeostazy w organizmach. Cztery różne cząsteczki, które mogą powstać w wyniku tej transanimacji (oksalooctan, α-ketoglutaran, asparaginian, L-glutaminian) są krytyczne dla wielu procesów metabolicznych. Oksalooctan i α-ketoglutaran odgrywają krytyczną rolę w cyklu Krebsa, różne formy asparaginianu są ważnymi cząsteczkami w cyklu mocznikowym i biorą udział w glukoneogenezie, a glutaminian jest ważną cząsteczką w szlakach metabolicznych związanych z pamięcią.
Zastosowania kliniczne
Poziomy AAT w organizmie wskazują na uszkodzenie tkanek i choroby. Normalnie AAT znajduje się w minimalnych ilościach we krwi, jednak gdy narządy wymienione powyżej są uszkodzone, AAT jest uwalniany do krwi. Ilość uwalnianego AAT jest proporcjonalna do poziomu doznanych uszkodzeń. Wykazano, że poziom AAT znacznie wzrasta w ciągu 6 godzin od początkowej degradacji tkanki i może pozostawać podwyższony nawet przez 4 dni. Poziomy AAT w porównaniu z poziomami innych enzymów mogą być wykorzystane przez lekarzy do określenia, w którym miejscu w organizmie doszło do uszkodzenia. Porównania z ALT okazały się szczególnie przydatne w identyfikacji uszkodzeń wątroby, takich jak marskość i zapalenie wątroby. W normalnych warunkach poziom AAT u mężczyzn wynosi 6-34 IU/L, a u kobiet 8-40 IU/L.
Struktury 3D aminotransferazy asparaginianowej
Struktury 3D aminotransferazy asparaginianowej
.