Zobrazowanie w reakcjach chemicznych
W tym rozdziale, dowiemy się o niektórych reakcjach, w których kluczowe kroki obejmują ruch pojedynczych elektronów. Możesz sobie przypomnieć, że w rozdziale 6.1A, ruch pojedynczego elektronu jest przedstawiony za pomocą strzałki z pojedynczą poprzeczką (w przeciwieństwie do znanych strzałek z podwójną poprzeczką, których używaliśmy w całej książce do przedstawienia ruchu dwóch elektronów).

Mechanizmy jednoelektronowe obejmują tworzenie i następującą po nim reakcję z wolnymi rodnikami, wysoce niestabilnymi związkami pośrednimi, które zawierają niesparowany elektron. W tym rozdziale dowiemy się jak wolne rodniki są często tworzone w wyniku rozszczepienia homolitycznego, zdarzenia, w którym dwa elektrony w rozpadającym się wiązaniu kowalencyjnym poruszają się w przeciwnych kierunkach.

(W przeciwieństwie do tego, zasadniczo wszystkie reakcje, które studiowaliśmy do tej pory obejmują zdarzenia rozpadu wiązań, w których oba elektrony poruszają się w tym samym kierunku: nazywa się to rozszczepieniem heterolitycznym).
Dowiemy się również, że wiele mechanizmów jednoelektronowych przyjmuje formę rodnikowej reakcji łańcuchowej, w której jeden rodnik powoduje powstanie drugiego rodnika, który z kolei powoduje powstanie trzeciego rodnika, i tak dalej.
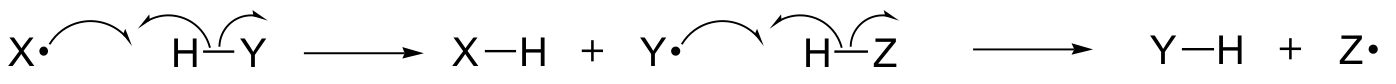
Wysoka reaktywność wolnych rodników i ich zdolność do inicjowania reakcji łańcuchowych jest często korzystna – w tym rozdziale dowiemy się o reakcjach polimeryzacji rodnikowej, które tworzą użyteczne materiały, takie jak pleksiglas i tkaniny polipropylenowe. Poznamy również reakcje rodnikowe, które są szkodliwe, takie jak degradacja ozonu atmosferycznego przez freon oraz oksydacyjne uszkodzenia lipidów i DNA w naszych organizmach przez wolne rodniki. Wreszcie, zobaczymy jak niektóre enzymy wykorzystują związane metale do katalizowania wysokich e
Geometria i względna stabilność rodników węglowych
Jako chemicy organiczni, jesteśmy szczególnie zainteresowani pośrednimi rodnikami, w których niesparowany elektron znajduje się na atomie węgla. Doświadczalne dowody wskazują, że trzy wiązania w rodniku węglowym mają geometrię trygonalnej planarnej, a zatem węgiel jest uważany za sp2-hybrydyzowany z niesparowanym elektronem zajmującym prostopadły, niehybrydyzowany 2pzorbital. Porównaj ten obraz z pośrednimi karbokationami i karbanionami, które są również trójgraniaste, ale których orbitale 2pz zawierają odpowiednio zero lub dwa elektrony.

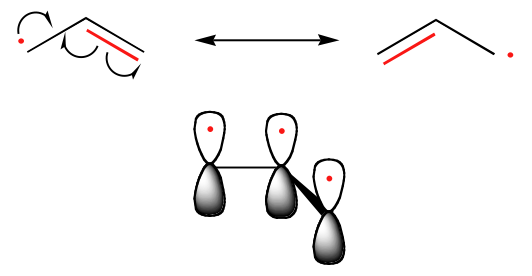
Tendencja w stabilności rodników węglowych jest analogiczna do tej w karbokationach (sekcja 8.4B): rodniki trzeciorzędowe, na przykład, są bardziej stabilne niż rodniki drugorzędowe, a następnie pierwszorzędowe i metylowe. Powinno to mieć intuicyjny sens, ponieważ rodniki, podobnie jak karbokationy, mogą być uważane za pozbawione elektronów, a zatem są stabilizowane przez efekt oddawania elektronów przez pobliskie grupy alkilowe. Rodniki benzylowe i allilowe są bardziej stabilne niż rodniki alkilowe ze względu na efekty rezonansowe – niesparowany elektron może być delokalizowany w układzie sprzężonych wiązań pi. Rodnik allilowy, na przykład, można przedstawić jako układ trzech równoległych orbitali 2pz dzielących trzy elektrony.
Trendy w stabilności rodników
Allyic & Benzlic > 3o > 2o > 1o > Methyl

W tej cząsteczce, już rozległa stabilizacja rezonansowa jest dodatkowo wzmocniona przez zdolność atomów chloru do osłaniania centrum rodnika przed zewnętrznymi odczynnikami. Rodnik znajduje się, w pewnym sensie, wewnątrz ochronnej „klatki”.
Organic Chemistry With a Biological Emphasis Tim Soderberg (University of Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (University of Illinois Springfield)
.