- Zwaveltrioxide Chemische eigenschappen, toepassingen, productie
- Chemische eigenschappen
- Fysische eigenschappen
- Toepassingen
- Productiemethoden
- Algemene beschrijving
- Lucht & Waterreacties
- Reactiviteitsprofiel
- Gevaar
- Gezondheidsrisico
- Vuurgevaar
- Veiligheidsprofiel
- Mogelijke blootstelling
- opslag
- Verlading
- Onverenigbaarheden
- Afvalverwijdering
Zwaveltrioxide Chemische eigenschappen, toepassingen, productie
Chemische eigenschappen
Zwaveltrioxide, S03, ook bekend als zwavelzuuranhydride, naalden of polymeer, bestaat in een aantal modificaties die verschillen in moleculaire soort en kristallijne vorm. Het heeft een witte, ijsachtige modificatie die smelt bij 16°C (61 °F) en twee andere als bestos-achtige vormen die smelten bij de hogere temperaturen van 33 en 62°C (90 en 144 °F). De kleurloze vloeibare of gasvormige vorm heeft irriterende, giftige dampen en kookt bij 45 °C.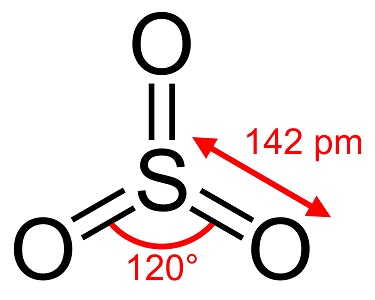
Zwaveltrioxide is een zeer reactieve stof, een sterk oxidatiemiddel, en een brandgevaar. Het reageert met metaaloxiden om sulfaten te vormen en met water om zwavelzuur te vormen. Zwaveltrioxide wordt gebruikt voor sulfonering.
Fysische eigenschappen
Kleurloze vloeistof bij omgevingstemperatuur en atmosferische druk; dampt in lucht.
Zwaveltrioxide heeft de neiging te polymeriseren, vooral in aanwezigheid van sporen van water of zwavelzuur. De polymerisatiesnelheid neemt echter sterk af naarmate het vriespunt wordt genaderd. Vast (polymeer) zwaveltrioxide bestaat in drie polymorfe fasen: alfa-, beta- en gammamodificaties.
De alfa-fase bestaat uit ijsachtige naalden met een polymere vernette structuur. Zij smelt bij 62,3°C en heeft een dampdruk van 73 torr bij 25°C.
De betafase is een metastabiele allotroop met witte, asbestachtige, glanzende naalden bestaande uit polymere moleculen, smelt bij 32,5°C en heeft een dampdruk van 344 torr bij 25°C.
De gammamodificatie kan bij gewone temperaturen bestaan in vaste of vloeibare vorm. In vaste vorm is het een colloïdale ijsachtige massa die smelt bij 16,8°C. In vloeibare vorm heeft het een dichtheid van 1,9224 g/mL en kookt het bij 44,8°C. Het heeft een dampdruk van 433 torr bij 25°C. De gammafase bestaat uit zowel cyclische trimeer- als monomeermoleculen. Wanneer vast zwaveltrioxide smelt, gaat het over in de gammafase, die bij stolling overgaat in de alfamodificatie.
Kritische temperatuur van SO3 is 217,8°C; kritische druk 80,97 atm; kritische dichtheid 0,63 g/cm3; de diëlektrische constante van vloeibaar SO3 bij 18°C is 3,11.
Zwaveltrioxide lost op in water waarbij zwavelzuur wordt gevormd en grote warmte vrijkomt.
Toepassingen
Zwaveltrioxide wordt gebruikt als tussenproduct bij de fabricage van zwavelzuur en oleum voor sulfonering, met name van kleurstoffen en verfstoffen, en voor de productie van watervrij salpeterzuur en explosieven. Zwaveltrioxide in vaste vorm wordt op de markt gebracht onder namen als Sulphan en Triosul, en wordt voornamelijk gebruikt voor het sulfoneren van organische zuren. Zwaveltetrafluoride is een fluoriderend middel. Zwavelhexafluoride dient als gasvormige isolator in elektrische hoogspanningsinstallaties. Zwavelfluoride wordt gebruikt als insecticide en als fumigant.
Sulfonering van organische verbindingen, vooral niet-ionische detergenten, zonne-energiecollectoren. Het wordt gewoonlijk gegenereerd in de fabriek waar het zal worden gebruikt.
Productiemethoden
Zwaveltrioxide wordt geproduceerd als tussenproduct bij de productie van zwavelzuur door middel van het contactproces (zie Zwavelzuur). Het proces omvat katalytische oxidatie van zwaveldioxide tot trioxide.
Zwaveltrioxide wordt in het laboratorium bereid door rokend zwavelzuur te verhitten, de dampen te laten condenseren en in een koele ontvanger op te vangen. Wanneer de dampen onder 27°C in aanwezigheid van sporenvocht worden gecondenseerd, ontstaan alle drie polymorfe fasen van SO3. Zij kunnen worden gescheiden door gefractioneerde destillatie. Condensatie van de dampen boven 27°C vormt de vloeibare variant van gamma-zwaveltrioxide.
Algemene beschrijving
Zwaveltrioxide is een kleurloze tot witte kristallijne vaste stof die gaat dampen in de lucht. Vaak verzonden met inhibitor om polymerisatie te verhinderen. Zwaveltrioxide reageert heftig met water om zwavelzuur te vormen waarbij warmte vrijkomt. Zwaveltrioxide is corrosief voor metalen en weefsel. Zwaveltrioxide veroorzaakt brandwonden aan ogen en huid. Inslikken veroorzaakt ernstige brandwonden in de mond, slokdarm en maag. De damp is zeer giftig bij inademing. Zwaveltrioxide is brandgevaarlijk wanneer het in contact komt met organische materialen zoals hout, katoen, vezelplaat, enz.
Lucht & Waterreacties
Combineert zich met water met explosieve kracht en vormt zwavelzuur door zijn zuurgraad Zwaveltrioxide verteerd de meeste organische stoffen. Bij blootstelling aan de lucht absorbeert zwaveltrioxide snel vocht, waarbij dichte witte dampen vrijkomen.
Reactiviteitsprofiel
De reactie van zwaveltrioxide en zuurstofdifluoride is zeer krachtig en er doen zich explosies voor als de reactie wordt uitgevoerd in afwezigheid van een oplosmiddel . De reactie van zwaveltrioxide in overmaat met tetrafluorethyleen veroorzaakt explosieve ontleding tot carbonylfluoride en zwaveldioxide . De reactie van watervrij perchloorzuur met zwaveltrioxide is hevig en gaat gepaard met de ontwikkeling van aanzienlijke warmte (Pascal 16:300 1931-34). Vloeibaar zwaveltrioxide reageert heftig met nitrylchloride, zelfs bij 75° C. De reactie van zwaveltrioxide en loodoxide veroorzaakt witte luminescentie. De combinatie van jodium, pyridine, Zwaveltrioxide en formamide ontwikkelde na enkele maanden een gasoverdruk. Dit is te wijten aan de langzame vorming van zwavelzuur, uit extern water of de dehydratie van de formamide tot waterstofcyanide.
Gevaar
Oxiderend agens, brandgevaar bij contact met anorganische materialen, een explosieve toename van de dampdruk treedt op wanneer de α-vorm smelt. De anhydride verbindt zich met water, waarbij zwavelzuur wordt gevormd en warmte vrijkomt. Zeer giftig, sterk irriterend voor het weefsel.
Gezondheidsrisico
Zwaveltrioxide is zeer giftig. Het is irriterend en bijtend voor de slijmvliezen. Giftig bij inademing of inslikken. Contact veroorzaakt ernstige brandwonden aan huid en ogen.
Vuurgevaar
Brandgevaar bij contact met organische materialen. Bij het smelten van de alfavorm treedt een explosieve verhoging van de dampdruk op. Combineert met water met explosief geweld en vormt zwavelzuur. Kan andere brandbare materialen (hout, papier, olie, enz.) doen ontvlammen. Ontvlambare giftige gassen kunnen zich ophopen in tanks en voorraadwagens. Afvoer naar riool kan brand- of explosiegevaar opleveren. Vormt zwavelzuur bij contact met water. Vermijd water en organische materialen. Bij blootstelling aan de lucht absorbeert zwaveltrioxide vocht en geeft het dichte witte dampen af.
Veiligheidsprofiel
Giftig bij inademing. Systemische effecten bij de mens bij inademing: hoest en andere pulmonale en olfactorische veranderingen. Bijtend irriterend voor huid, ogen en slijmvliezen. Reageert heftig met O2F2, PbO, NClO2, HClO4, P, tetrafluorethyleen, acetonitril, zwavelzuur, dimethylsulfoxide, dioxan, water, difenylkwik, formamide, jodium, pyridine, metaaloxiden. Reageert met stoom en vormt bijtende, giftige dampen van zwavelzuur. Bij verhitting tot ontleding komen giftige dampen van SO Zie ook SULFZUUR.
Mogelijke blootstelling
Zwaveltrioxide wordt gebruikt als zwavel- en sulfoneermiddel voor detergenten, smeerolietoevoegingen, en andere organische verbindingen; in zonne-energiecollectoren. Het wordt ook gebruikt als tussenproduct bij de vervaardiging van zwavelzuur en bij het maken van explosieven.
opslag
De dampspanning van zwaveltrioxide stijgt snel bij stijgende temperatuur en wanneer de α-vorm smelt, is de drukstijging explosief; daarom moeten transport- en opslagvaten bestand zijn tegen drukken van 10 tot 15 atm. Zwaveltrioxide reageert krachtig en zeer exotherm met water, waarbij waterstofzwavelzuur ontstaat. Bij blootstelling aan vochtige lucht dampt het uit en vormt het een nevel van zwavelzuur die uiteindelijk alle beschikbare ruimte vult; het tast ook metalen aan. Het is een krachtig oxidatiemiddel en in de vloeibare fase carboniseert het organische materialen.
Verlading
UN1829 Zwaveltrioxide, gestabiliseerd, Gevarenklasse: 8; Etiketten: 8-Corrosief materiaal, 6.1-Giftig bij inademing, Inhalatiegevaar Zone B.
Onverenigbaarheden
Brandbaar en bijtend. Een sterke oxidator. Reageert heftig met water, stoom of vocht, waarbij corrosief hydrozwavelzuur vrijkomt. Heftige reacties treden op bij contact met sterke basen; sterke zuren, chemisch actieve metalen; reductiemiddelen; fijn verdeeld metaal; cyaniden, nitraten, picraten, fulminaten, chloraten, sulfiden, carbiden, fosfor, dioxygeendifluoride, bariumoxide; loodoxide; difenylkwik; alcoholen, nitrylchloride; acetonitril, dioxaan, tetrafluorethyleen.
Afvalverwijdering
Retourneer hervulbare cilinders met samengeperst gas aan de leverancier. Niet hervulbare cilinders moeten worden verwijderd in overeenstemming met de lokale, staats- en federale voorschriften. Laat het resterende gas langzaam ontsnappen in de atmosfeer in een niet afgesloten ruimte of afzuigkap. Hervulbare cilinders moeten worden geretourneerd aan de oorspronkelijke leverancier met alle ventieldoppen en uitlaatpluggen vastgezet en ventielbeschermkappen op hun plaats.